4. ПРОДУКТ ВЗАИМОДЕЙСТВИЯ НЕОЧИЩЕННОЙ СУММЫ АЛКАЛОИДОВ ЧИСТОТЕЛА С ТИОФОСФАМИДОМ
ПРЕПАРАТ АМИТОЗИН
Амитозин получен методом алкилирования третичного азота суммы алкалоидов изохинолинового ряда чистотела представителем алкилирующих агентов из группы этиленимина тиофосфамидом. Это первый препарат из нового класса алкалоидэтилениминов — фитохимических соединений, обладающих разносторонним биологическим действием.
Первый вариант амитозина готовился с применением не полностью очищенной суммы алкалоидов и содержал кроме основных действующих веществ смоляные кислоты, смолы, макро- и микроэлементы.
4.1. МЕТОДИКА ПРИГОТОВЛЕНИЯ СГУЩЕННОГО ЭКСТРАКТА ЧИСТОТЕЛА
В эмалированную посуду или сосуд из нержавеющей стали помещали 1 кг измельченного высушенного растения, содержащего не менее 30 % корней и собранного в конце вегетации в период созревания плодов (июль — август). После предварительного промывания в проточной воде его заливали 5—8 л дистиллированной воды. Оставляли на 24 ч при комнатной температуре, после чего кипятили на слабом пламени в течение 24 ч, затем оставшийся водный раствор сливали в стеклянную или эмалированную посуду, а к растительному сырью повторно добавляли 5—8 л дистиллированной воды и кипятили на слабом пламени в течение 12 ч. При необходимости доливали 1—2 л воды.
Полученный отвар смешивали с первой порцией, отстаивали в течение 10 ч при температуре +8—+10°С, фильтровали, упаривали до объема 200—250 мл. К остатку добавляли 1000 мл 96° этилового спирта. После интенсивного взбалтывания в течение 30—40 мин спиртовую смесь отстаивают в делительной воронке при комнатной температуре в течение 12 ч, отделяют нижнюю фазу (смолы и экстракт). Верхнюю спиртовую часть фильтруют через двухслойный бумажный фильтр и отгоняют спирт при температуре 60—70 °С.
К оставшемуся экстракту, содержащему алкалоиды, загрязненные смолами, добавляют 0,3 л дистиллированной воды и 0,15 л 96° этилового спирта, встряхивают 30—40 мин, отстаивают 12 ч при комнатной температуре в делительной воронке. Смолы (нижнюю фазу) выбрасывают. Верхнюю водно-спиртовую фазу фильтруют через трехслойный бумажный фильтр, отгоняют спирт и объединяют с первой порцией. Этот водный экстракт, содержащий сумму основных алкалоидов чистотела, автоклавируют при 100 °С, смешивают с противоопухолевым препаратом тиофосфамидом (20 мг препарата /мл экстракта) в стерильных флаконах и оставляют при 37 °С в термостате в течение 48—72 ч при постоянном взбалтывании. Полученный в результате этого препарат амитозин хранят в холодильнике и используют согласно инструкции.
4.2. МЕТОДЫ ИСПЫТАНИЯ ЭКСТРАКТА ЧИСТОТЕЛА
В Государственной Фармакопее (IX издание) нет данных по методике исследования экстракта чистотела, поэтому нами на основании литературных и экспериментальных данных разработаны и применялись следующие методы испытания экстракта.
Испытание на подлинность. Каплю экстракта помещали на полоску фильтровальной бумаги и высушивали при температуре 60 °С в течение 10—15 мин. Затем помещали её в аппарат для макролюминесцентного анализа витаминов — наблюдалась яркая золотистая флуоресценция в ультрафиолетовых лучах, которая должна сохраняться после промывания фильтровальной бумаги в дистиллированной воде в течение 2—3 мин. Кроме того, проверяли окрашивание, образовавшееся при смешивании 0,2 мл экстракта с 2 мл 96° спирта, концентрированной азотной кислотой, а также концентрированной серной кислотой с незначительной примесью хромовокислого калия.
При смешивании со спиртом выпадает густой темный осадок, который фиксирован к стенкам пробирки. Раствор над осадком прозрачный, со слабым зеленовато-желтым оттенком. При смешивании экстракта с азотной кислотой образуется прозрачный раствор с интенсивной вишнево-красной окраской, сохраняющейся в течение 48 ч и более.
При смешивании с концентрированной серной кислотой с незначительной примесью хромовокислого калия образуется густая непрозрачная жидкость темно-бурого цвета.
Определение сухого остатка, 5 мл экстракта помещали во взвешенный бюкс высотой 2—3 и диаметром 5—7 см, выпаривали на водяной бане и сушили в течение 3 ч при температуре 100—105 °С. В 1 мл экстракта содержится 400—600 мг сухого остатка.
Определение тяжелых металлов. 1 мл экстракта выпаривали досуха, прибавляли 1 мл концентрированной серной кислоты, осторожно сжигали и прокаливали. Полученный остаток обрабатывали при нагревании 5 мл насыщенного раствора ацетата аммония. Фильтровали через безводный фильтр, промывали 5 мл воды, доводя фильтрат водой до 200 мл. 10 мл полученного раствора не должны содержать тяжелых металлов более чем 10 мл эталонного раствора, т. е. не более 0,01 % в препарате.
Количественное определение. Количественное определение алкалоидов в экстракте чистотела проводилось нами с помощью метода, описанного в диссертации Г. Вейса. С этой целью 2,5 мл экстракта растворяли в 12 мл 50° этилового спирта и 1 мл водного аммиака и помещали в делительную воронку. К смеси прибавляли 30—40 г хлороформа и взбалтывали в течение 1 ч. Эмульсию устраняли с помощью нескольких капель абсолютного спирта.
После взбалтывания нижний хлороформный слой собирали, а верхний экстрактный — подвергали новому взбалтыванию с хлороформом (3 раза по 15 мин с прибавлением каждый раз по 30 г хлороформа). Полученные вытяжки после испарения хлороформа растворяли в 10 мл дистиллированной воды, подкисленной соляной кислотой; раствор слегка насыщали аммиаком и подвергали вторично четырехкратному взбалтыванию с хлороформом.
Затем хлороформ испаряли, а оставшуюся массу растворяли в 5 мл 0,1 н. раствора НСl при обычной температуре фильтровали через небольшой фильтр, который после этого тщательно промывали горячей водой. После прибавления к раствору нескольких капель индикатора метилового красного производили титрование 0,01 н. раствором NaOH. Количество (мл) израсходованного для титрования раствора NaOH вычиталось из 5 мл 0,1 н. НСl. Остаток показывал, сколько НСl понадобилось для связывания алкалоидов. Умножением этого числа на показатель хелидонина (0,0625) определяли общее количество алкалоидов в пересчете на хелидонин. Приготовленный нами экстракт содержал 7,5—8 % алкалоидов.
4.3. ТОКСИЧНОСТЬ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ НЕОЧИЩЕННОГО ВАРИАНТА АМИТОЗИНА
В опытах по определению токсичности амитозин вводили животным в виде 10 % раствора в изотоническом растворе хлористого натрия. Растворы аналогичной концентрации применялись нами в большинстве опытов и при изучении противоопухолевых свойств препарата (табл. 4).
Из приведенных данных видно, что холоднокровные животные (лягушки) обладают высокой чувствительностью к амитозину и погибают уже через несколько часов после введения смертельных доз. Средняя смертельная доза (ЛД50) для лягушек оказалась почти в 4 раза ниже ЛД50 для морских свинок и в 11—17 раз ниже средней смертельной дозы для мышей, кроликов и крыс.
Теплокровные животные мало чувствительны к амитозину. Наиболее устойчивыми в наших опытах оказались кролики, мыши и крысы. Средняя смертельная доза для этих животных превышает применяемую нами терапевтическую дозу (100 мг/кг) более чем в 10 раз. Лишь морские свинки менее устойчивы к препарату (ЛД50 = 347 мг/кг).
Введение амитозина теплокровным животным в дозах, незначительно превышающих максимально переносимые (ДПМ), вызывает гибель, как правило, единичных животных через несколько дней после инъекции. При этом у них постепенно ухудшается аппетит, происходит снижение массы (на 10—20%), позже наступает адинамия и смерть. Незадолго до гибели у некоторых животных наблюдается понос слизью. При вскрытии таких животных специфических изменений в органах не наблюдается, за исключением некоторого полнокровия внутренних органов, кроме селезенки. Иногда отмечается вздутие кишечника. Гистологические исследования внутренних органов погибших животных (печень, почки, селезенка, сердце), а также костного мозга заметных изменений в их структуре не выявили. Анализ периферической крови этих животных показал незначительно выраженную лейкопению с лимфопенией и тромбоцитопению (изменения статистически недостоверны).
Введение препарата в дозах, близких к средней смертельной дозе или превышающих ее, приводит животных к гибели через несколько часов. У некоторых животных незадолго до гибели наблюдали тонические и клонические судороги, наиболее выраженные у холоднокровных. При вскрытии погибших животных отмечали переполнение кровью органов брюшной полости, особенно сосудов брыжейки, вздутие кишечника, иногда явления энтероколита. Сердце останавливалось в состоянии диастолы.
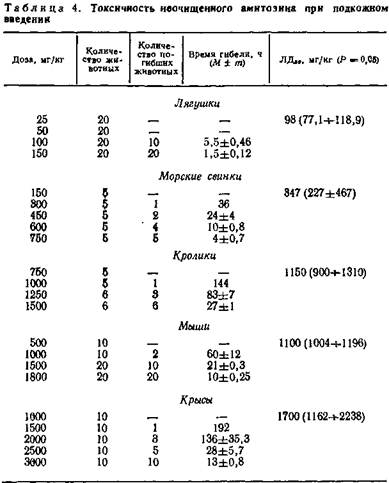
Гистологическим исследованием установлено наличие дистрофических изменений во внутренних органах, чаще всего в печени. Незначительная лейкопения наблюдается лишь у некоторых животных, продолжительность жизни которых превышает сутки после введения препарата. Изменений картины костного мозга у погибших животных не отмечено.
В опытах на крысах изучена токсичность амитозина при различных путях его введения (табл. 5).
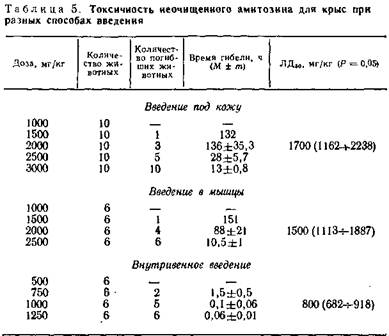
Внутримышечное введение препарата вызывает гибель животных несколько раньше и смерть наступает от меньших доз, чем при подкожном введении, но эта разница статистически не существенна. В то время как при внутривенном введении амитозина подопытные животные гибнут гораздо раньше и при введении меньших доз, чем в опытах с введением его под кожу и в мышцы.
Изучение кумулятивных свойств препарата с помощью определения индекса кумуляции проведено также в опытах на крысах. Оказалось, что максимально переносимая доза амитозина при однократном подкожном введении (МПД1) для крыс составляет 1000 мг/кг. А максимально переносимая доза при пятикратном введении с интервалами в 5 дней (МПДп) составляет 650 мг/кг. Индекс кумуляций, вычисленный по формуле В. А. Чернова на основании определения максимально переносимых доз, оказался равным 13,46.
Полученные данные позволяли определить с помощью метода Л. Ф. Ларионова обратимость токсического действия амитозина при подкожном введении максимально переносимых доз. Индекс обратимости токсического действия препарата при таком способе введения достигает 3,25.
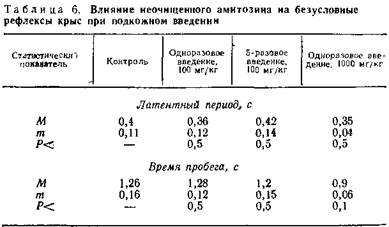
4.3.1. Влияние различных доз амитозина на функцию органов и систем. Влияние амитозина на центральную нервную систему. В опытах на 24 крысах изучалось влияние различных доз амитозина на безусловные и условные рефлексы.
Для выработки условных рефлексов у животных использована двигательно-оборонительная методика с электрокожным подкреплением. Условный рефлекс вырабатывали на белый свет электрической лампочки. В качестве безусловного раздражителя использовали электрический ток напряжением 20—30, который пропускали по латунным пластинкам пола камеры. Красный свет электрической лампочки применяли как дифференцировку.
В процессе опыта отмечали порядковый номер раздражителя, изолированное действие условного раздражителя, общее его действие с безусловным раздражителем, латентный период двигательной реакции, время пробежки крысы от одной стороны камеры к другой в секундах, а также изменения в общем поведении животного. Одновременно производили графическую регистрацию опыта на ленте кимографа.
После выработки стереотипа и определения типологических особенностей высшей нервной деятельности животные были разделены на две равноценные по типологической характеристике группы — подопытную и контрольную. Подавляющее большинство животных (20 крыс) принадлежали к сильному уравновешенному типу. Подопытным животным вводили амитозин, а контрольным — равный объем изотонического раствора хлористого натрия.
Изучено влияние терапевтической дозы амитозина (100 мк/кг) при одно- и пятикратном введении под кожу с промежутками в 5 дней (аналогично применяемому нами курсу лечения), а также влияние однократного введения субтоксической дозы препарата (1000 мг/кг) (табл. 6).
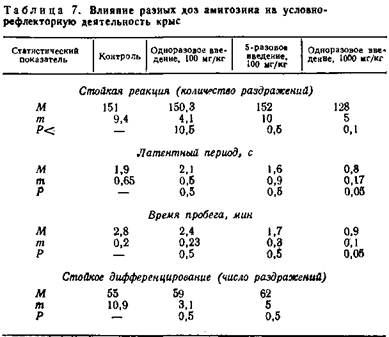
Отмечается, что существенной разницы между безусловной реакцией контрольных и подопытных крыс нет. Вместе с тем наблюдается тенденция к укорочению латентного периода и времени пробежки у подопытных крыс после введения субтоксической дозы амитозина (разница статистически не существенная) (табл. 7).
Однократное введение под кожу амитозина в дозе 100 мг/кг, а также многократное не сказываются существенным образом на условнорефлекторной деятельности животных. В то же время однократное введение субтоксической дозы вызывает статистически достоверное укорочение латентного периода условной реакции на свет и времени пробежки животного (повышение величины рефлекса).
Действие амитозина на деятельность сердца. При подкожном и внутримышечном введении терапевтических доз амитозина (100 мг/кг) заметных изменений в сердечной деятельности не отмечено. На электрокардиограмме, как и до введения препарата, хорошо выражен предсердечный и желудочный комплексы. Зубец Р лучше выражен во II отведении, продолжительность его 0,04—0,06 с, высота 0,1—0,15 мВ. Зубец Q встречается редко и выражен плохо, высота его не превышает 0,1 мВ. Интервал Р — Q в зависимости от чистоты сердечных сокращений колеблется в пределах 0,06—0,08 с и располагается чаще всего изоэлектрично.
Продолжительность желудочного комплекса QRS в среднем 0,04—0,06 с, максимальная высота зубца 0,65 мВ. Интервал — ST располагается на изоэлектрической линии, продолжительность его 0,12—0,16 с. Зубец Т, как правило, положительный, высота его 0,07—0,1 мВ.
Электрическая система желудочков QRST, в зависимости от частоты сердечных сокращений, колеблется от 0,13 до 0,2 с. Интервал Т — Р также зависит от частоты сердечных сокращений и составляет 0,07—0,1 с.
При введении под кожу и в мышцы субтоксических доз препарата через несколько часов после введения наблюдались некоторая брадикардия и снижение высоты зубца Р. В ряде случаев в I отведении отчетливо был виден зубец Q. На следующий день после введения эти изменения уже не определялись. Заметных изменений кровяного давления и дыхания при таком способе введения амитозина не было.
В то же время при внутривенном введении даже терапевтических доз препарата на электрокардиограмме отчетливо заметны изменения, аналогичные описанным при введении в мышцы и под кожу субтоксических доз. Наблюдается слабо выраженное кратковременное снижение кровяного давления, которое вскоре несколько повышается. Дыхание становится более глубоким и редким, но через 20—30 мин эти изменения исчезают.
Внутривенное введение субтоксических доз амитозина уже через несколько минут приводит к резким расстройствам сердечной деятельности, а иногда к остановке сердца. Ритм сокращений сердца замедляется в 4—5 раз, резко искажается предсердный и желудочковый комплекс, который растянут во времени. Деформированы все зубцы и особенно резко выражен зубец Q во всех отведениях. Если животное не гибнет в первые минуты после введения, то через несколько часов деятельность сердца восстанавливается, сохраняется лишь незначительная брадикардия. На следующие сутки заметных изменений на электрокардиограмме уже не наблюдается.
Влияние амитозина на функцию почек. В опытах на 23 животных (крысы-самцы и собаки-самки) изучено влияние различных доз амитозина при введении его под кожу в обычных условиях и при водной нагрузке.

В опытах на собаках использована методика выведения мочеточников.
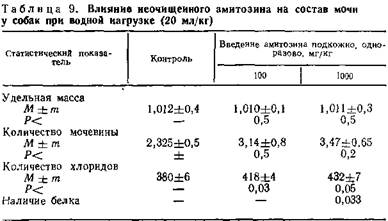
При изучении влияния различных доз препарата на количество выделившейся мочи оказалось, что амитозин вызывает некоторое статистически не существенное увеличение диуреза, особенно при водной нагрузке (табл. 8, 9).
Введение амитозина в терапевтической дозе не вызывает статистически достоверных изменений удельной массы мочи и содержания в ней мочевины и хлоридов. В то же время введение препарата в субтоксической дозе приводит к значительному увеличению количества хлоридов в моче. Применение препарата в таких дозах сопровождается также появлением следов белка в моче.
Влияние амитозина на функции печени. В опытах на 13 животных (собаки, крысы) изучено влияние амитозина на желчевыделительную и белковообразовательную функцию печени.
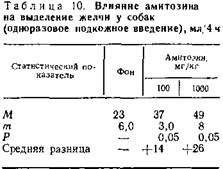
У собак с фистулой желчного пузыря после определения «фона» — количества выделившейся желчи натощак в течение 4 ч, изучали влияние различных доз введенного под кожу амитозина на количество выделившейся желчи (табл. 10). Определено выраженное желчегонное действие терапевтической (100 мг/кг) и субтоксической (1000 мг/кг) дозы амитозина.
При рефрактометрическом определении содержания белка оказалось, что в сыворотке крови интактных крыс содержится 8,2±0,15 % белка. Реакция Таката-Ара у всех интактных животных отрицательная.
Введение под кожу 100 мг/кг амитозина сопровождается некоторым статистически не существенным повышением содержания сывороточного белка (9,85±0,31 %). Реакция Таката-Ара у всех подопытных животных, получивших такую дозу препарата, остается отрицательной. Однократное введение под кожу субтоксической дозы амитозина (1000 мг/кг) приводит к статистически достоверному снижению содержания белка (5,8±0,15 % в контроле), у некоторых животных (3 из 10) отмечается положительная реакция Таката-Ара.
Таким образом, разработанная методика получения противоопухолевого препарата амитозина, выделенного из суммы алкалоидов из сгущенного водного экстракта чистотела и синтетического препарата тиофосфамида, технически проста и не требует специального оборудования.
Терапевтические дозы препарата (100 мг/кг) при внутримышечном введении не вызывают нарушений структуры и функции внутренних органов и систем и не угнетают кроветворение. Амитозин в терапевтической дозе обладает желчегонным действием. Субтоксические и токсические дозы препарата (1000—3500 мг/кг) приводят к дистрофическим изменениям внутренних органов, особенно печени, вызывают нарушение функции центральной нервной системы, сердечно-сосудистой, мочевыделительной системы и печени.
А.И.Потопальский
Препараты чистотела в биологии и медицине
|