4.4. ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ НЕОЧИЩЕННОГО АМИТОЗИНА, ТИОФОСФАМИДА И ЭКСТРАКТА ЧИСТОТЕЛА
В качестве модели экспериментальной саркомы использована индуцированная метилхолантреном саркома крыс штамм МТХ, а эпителиальной — метастазирующий вариант карциномы крыс Герена. Моделью экспериментального лейкоза служил перевиваемый лимфатический лейкоз (лимфосаркома) мышей штамма ЛИО-1.
Лечение опухолей крыс начинали через 14 дней после инокуляции при значительных размерах опухолей. В одной из серий опытов с карциномой Герена лечение начинали через 21 день после перевивки.
В опытах с лимфолейкозом ЛИО-1 лечение начинали через 48 ч после инокуляции, когда в пунктате из лимфатических узлов были обнаружены опухолевые клетки. Такие сроки начала лечения позволяли судить не о профилактических, а о лечебных свойствах препарата.
Основным критерием противоопухолевой активности амитозина в опытах на крысах являлось полное рассасывание опухолей, подтвержденное патологоанатомическим и гистологическим исследованиями, а также отсутствием рецидива в течение 6 мес. В отдельных сериях опытов эффективность препарата учитывалась путем определения процента торможения роста опухолей.
С целью изучения механизма действия амитозина учитывали также гистологические, гистохимические и люминесцентные изменения в опухолях в процессе лечения. Кроме изменений обычной гистологической структуры опухолей, изучено антимитотическое действие препарата путем определения митотического индекса (количества делящихся клеток на 1000 подсчитанных в препарате). Нуклеиновые кислоты (ДНК и РНК) в опухолевых клетках выявляли с помощью характерных гистохимических реакций, а затем определяли изменения содержания их в ядрах клеток в процессе лечения с помощью цитофотометрии. Способность амитозина к флуоресценции в ультрафиолетовых лучах использована для люминесцентного исследования опухолей и органов леченых животных с целью определения избирательного накопления препарата опухолью.
Изменения биохимических процессов в организме животных в процессе развития и лечения экспериментальных опухолей определяли путем изучения активности гликолитического фермента сыворотки крови — альдолазы и окислительного медьсодержащего фермента — церулоплазмина. Активность альдолазы определяли по методу В. И. Товарницкого и В. Г. Обуховой, а активность церулоплазмина — по методике Г. А. Бабенко.
Критерием эффективности амитозина в опытах с лимфолейкозом мышей ЛИО-1 являлось отсутствие опухоли на месте инокуляции и лейкозных изменений в органах через 10 дней после прививки, а также отсутствие рецидива в течение 3 мес.
В связи с тем, что большинство из существующих противоопухолевых препаратов угнетают ткани с интенсивной пролиферацией и особенно кроветворную, в процессе лечения, а также после его окончания нами изучено действие амитозина на кроветворение путем многократного исследования периферической крови леченых животных. Одновременно анализировалась периферическая кровь контрольных животных.
В предварительных опытах по изучению противоопухолевого действия амитозина была установлена наиболее эффективная методика введения (3—5 подкожных инъекций препарата в дозе 100 мг/кг с интервалами в 5 и 7 дней в опытах на крысах и 2 дня в опытах на мышах), которая применялась во всех последующих вариантах опытов.
Первые эксперименты на крысах с индуцированной метилхолантреном полиморфноклеточной саркомой МТХ показали высокую противоопухолевую активность амитозина. Опухоли, средний диаметр которых к моменту начала лечения (14 дней после инокуляции) достигали 1,2±0,15 см, после курса введения амитозина у всех животных полностью рассасывались. Но при интервалах между инъекциями препарата в 7 дней клиническое выздоровление животных наступало позднее, чем при интервалах в 5 дней (32±1,6 дня вместо 27±0,9 дней), и темпы рассасывания опухоли были ниже. В этих опытах была установлена высокая избирательность противоопухолевого действия амитозина, которая выявлялась не только в полном рассасывании опухолей без видимых токсических проявлений и отсутствии изменений в органах, но и в отсутствии угнетающего действия амитозина из кроветворения. При многократном исследовании периферической крови в процессе лечения и после его окончания заметных изменений не наблюдалось, за исключением тромбоцитопении.
Аналогичные результаты получены также в опытах с малодифференцированной эпителиальной злокачественной опухолью крыс — карциномой Герена.
При начале лечения через 14 дней после инокуляции опухоли все животные выздоровели. Отличий в окончательных результатах при лечении с интервалами между инъекциями в 5 и 7 дней не было, опухоли леченых животных рассосались, но при интервалах в 7 дней сроки выздоровления удлинялись (30± 1,1 дней вместо 23 дней).
В связи с тем, что эта опухоль интенсивно метастазирует в регионарные лимфоузлы, в опытах с карциномой Герена проводилось изучение влияния амитозина на скорость рассасывания метастазов. Было отмечено более интенсивное рассасывание метастатических узлов по сравнению с основной опухолью. Через 10—15 дней после начала лечения метастатические узлы, как правило, не определялись.
С целью изучения влияния амитозина на «запущенные» опухоли в одной из серий опытов лечение было начато на 21-й день после инокуляции, когда опухоль в некоторых случаях составляла 15—20 % массы тела животных со средним диаметром 2,5±0,5 см. Метастатические узлы у некоторых животных этой группы достигали значительных размеров (1,5X2 см). Препарат в этой серии опытов вводили с интервалами в 5 дней. Сроки выздоровления животных при таком позднем сроке начала лечения значительно удлинялись. Полное рассасывание опухоли наступало в среднем через 41 ±4 день, а метастатических узлов — в течение первых двух недель лечения.
Все контрольные животные, не получившие амитозина, с саркомой МТХ погибли на 34±2,5 день, а с карциномой Герена через 32,6±1,8 дней после инокуляции опухоли.
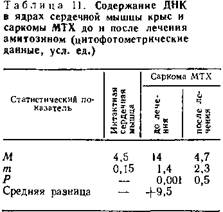
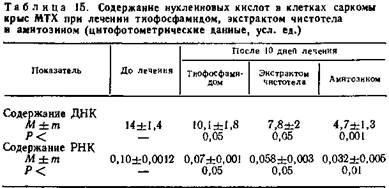
Гистологические и гистохимические изменения в опухолях в процессе рассасывания саркомы МТХ и карциномы Герена были в основном идентичными: в первые 24—48 ч после введения препарата наблюдаются уменьшение содержания нуклеиновых кислот и торможение процесса деления опухолевых клеток (табл. 11).
В последующие 3—5 дней резко уменьшается количество митозов, видны патологические формы митоза. Митотический индекс саркомы МТХ, равный до лечений 43±8,8, через 5 дней после введения амитозина уменьшался до 16±20 %, т. е. почти в 3 раза, а митотический индекс карциномы Герена к этому времени уменьшился почти в четыре раза.
В это же время происходят характерные изменения в гистологической структуре опухолей; просветление ядер, кариорексис, кариолизис, местами разрастание соединительной ткани. Указанные изменения особенно выражены на 10—14-й день после начала лечения и в более поздние сроки нарастают. К 20—25-у дню после начала лечения у большинства животных при гистологическом исследовании жизнеспособные опухолевые клетки не выявлены. При гистологическом исследовании тканей, взятых из места расположения бывшей опухоли после клинического выздоровления, подкожная клетчатка имеет обычное строение. Лишь в единичных случаях в подкожной клетчатке определяются ограниченные поля из соединительной ткани.
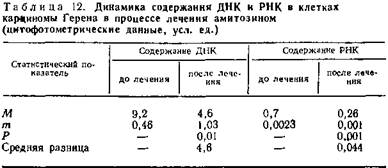
Путем определения с помощью метода цитофотометрии содержания ДНК, на клеточное ядро удалось отметить интересную закономерность изменения ее содержания в процессе лечения. Содержание ДНК в ядрах опухолевых клеток саркомы МТХ и карциномы Герена в 2—3 раза выше, чем в ядрах дифференцированной ткани мышцы сердца. Через 10 дней после начала лечения амитозином содержание ДНК в опухолевых клетках приближается к таковому нормальной ткани.
Еще более выражены изменения содержания РНК в протоплазме опухолевых клеток. Уже через 10 дней после начала лечения содержание РНК в клетках саркомы МТХ более чем в три раза ниже такового до лечения, а в клетках карциномы Герена уменьшается почти в 3 раза (табл. 12).
При люминесцентном исследовании опухолей и метастатических узлов в первые дни лечения отмечалась характерная для амитозина желто-оранжевая флуоресценция. Интенсивность последней с увеличением числа инъекций возрастала, достигая максимума к 20 дню лечения. В опухолях контрольных животных, а также в других органах подопытных животных такой флуоресценции не отмечалось, что может свидетельствовать об избирательном накоплении препарата опухолевой тканью.
С целью изучения изменений обмена веществ в организме животных с экспериментальными опухолями в процессе развития опухолей и их лечения амитозином мы определяли изменения активности гликолитического фермента альдолазы и медьсодержащего фермента церулоплазмина.
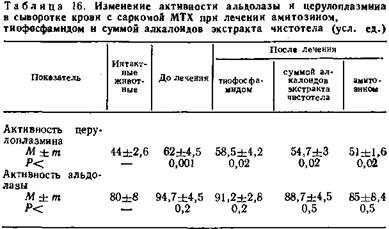
Активность альдолазы сыворотки крови крыс возрастает по мере развития опухолей, достигая максимума накануне гибели животных. Повышение активности альдолазы более значительно у животных с саркомой МТХ. В процессе лечения амитозином активность фермента приближается к уровню цифр, характерных для интактных животных.
Полученные нами данные согласуются с наблюдением о параллельной зависимости между снижением активности эльдолазы и эффективностью лечения злокачественных опухолей сарколизином.
При изучении церулоплазмина отмечено значительное повышение его активности в процессе развития саркомы МТХ. В процессе развития карциномы Герена активность этого фермента, наоборот, снижается. В процессе лечения животных с саркомой МТХ и карциномой Герена амитозином наблюдается постепенная нормализация активности церулоплазмина. Различия в его активности вероятно, связаны с особенностями обмена веществ при этих опухолях.
Содержание церулоплазмина, являющегося α-2-глобулином, тесно связано с содержанием этой фракции белков в сыворотке крови. При саркоме МТХ, как и при большинстве других опухолей, содержание α-2-глобулинов повышено, а при карциноме Герена, резко снижается.
Нормализация активности альдолазы и церулоплазмина при лечении опухолей амитрзином свидетельствует о том, что процесс рассасывания экспериментальных опухолей сопровождается постепенной нормализацией нарушений обмена веществ в организме животного — носителя опухоли.
Заслуживает внимания отсутствие заметных осложнений у подопытных животных в процессе лечения и после его окончания. Лишь у нескольких животных на месте инъекции препаратов оставался асептический инфильтрат, который через 7—10 дней рассасывался.
Масса леченых животных, как правило, увеличивалась. Масса контрольных животных в процессе роста опухоли также увеличивалась, но без учета массы развившейся опухоли, к концу наблюдения масса большинства из них была ниже исходных цифр.
При наблюдении за излеченными животными в течение 6—12 месяцев после видимого рассасывания опухолей рецидивы не наблюдались.
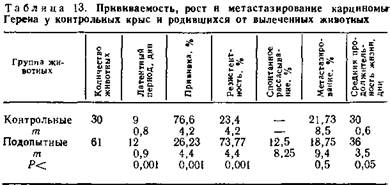
С целью изучения восприимчивости потомства животных к штамму опухоли, рассосавшейся у их родителей под влиянием лечения амитозином, проведены опыты с карциномой Герена. При инокуляции этой опухоли крысятам, родившимся от излеченных животных, а также интактным крысятам в возрасте 1—6 мес. была отмечена существенная разница в прививаемости опухоли, сроках ее появления, интенсивности метастазирования и продолжительности жизни (табл. 13).
Прививаемость опухоли в подопытной группе оказалась почти в три раза ниже, чем среди контрольных крысят. Латентный период появления опухоли в контрольной группе был короче, интенсивность метастазирования выше, а продолжительность жизни меньше, чем у крысят, родившихся от излеченных родителей. Кроме того, у 12,5 % подопытных крысят наступило спонтанное рассасывание опухоли, чего никогда не наблюдалось в контрольной группе.
Полученные данные свидетельствуют о выработке невосприимчивости в первом поколении потомства выздоровевших животных и привитых той же опухолью, которая была излечена у их родителей.
Лечение мышей с лимфатическим лейкозом ЛИО-1 начинали через 48 ч после прививки, когда в пунктате из лимфатических узлов в месте инокуляции были обнаружены опухолевые клетки. Все животные подопытной группы считались излеченными, если опухоль через 10 дней после инокуляции у них не развивалась. К этому времени каждому животному было введено по 5 инъекций При последующем наблюдении за излеченными животными в течение 3 мес. рецидивов опухоли не было. Все контрольные животные погибли в среднем через 16±3 дня после инокуляции опухоли. К этому времени у них наблюдались характерные изменения в крови и внутренних органах, опухоль на месте инокуляции достигала значительных размеров.
Гистологические и гистохимические изменения в процессе лечения лимфолейкоза мышей были в основном идентичны уже описанным при лечении опухолей крыс.
При люминесцентном исследовании лимфатических узлов и внутренних органов леченых животных характерной для амитозина флуоресценции не отмечалось, что может быть связано с генерализацией опухолевого процесса.
В периферической крови животных после инокуляции опухоли резко увеличивается количество лейкоцидов, появляются лимфобласты, количество тромбоцитов уменьшается. После лечения амитозином происходит нормализация картины крови, сохраняется лишь умеренная тромбоцитопения.
С целью изучения противоопухолевого действия компонентов, входящих в состав амитозина, проводились сравнительные опыты по изучению эффективности экстракта чистотела, тиофосфамида и амитозина. Кроме того, изучена активность растворенного в изотоническом растворе тиофосфамида после его хранения в течение 10 дней аналогично условиям приготовления амитозина. В опыты брали крыс с саркомой МТХ и карциномой Герена. Так как тиофосфамид в дозе 30 мг/кг, т. е. в той дозе, в которой он применяется будучи в составе амитозина, вызывает гибель большинства животных в 1—2-й день после введения, то в дальнейшем его применяли в максимально переносимой дозе 3 мг/кг.
Экстракт чистотела вводили в дозе 1 мл/кг, аналогично дозе экстракта, применяемой при получении амитозина. Для создания одинаковых условий опыта лечение во всех случаях было начато через 14 дней после инокуляции опухоли. Каждый из препаратов вводили подкожно с промежутками между инъекциями (5) в 5 дней.
Противоопухолевый эффект оценивали через 22 дня после начала лечения на основании определения процента торможения роста опухолей.
Выбор срока оценки эффективности лечения обусловлен тем, что к этому периоду (36-й день после инокуляции) большинство контрольных животных погибает.
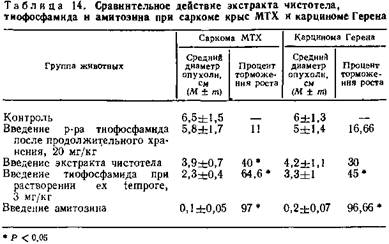
После введения тиофосфамида в дозе 3 мг/кг при растворении его непосредственно перед введением торможение роста саркомы крыс МТХ равно 64,6 %, а карциномы Герена — 45 %.
Введение раствора тиофосфамида в дозе 20 мг/кг после хранения раствора в течение 10 дней практически не оказывает влияния на рост опухолей крыс (процент торможения роста равен 11 и 16,66 %).
Экстракт чистотела приводит к торможению роста саркомы МТХ на 40 %, а карциномы Герена лишь на 30 % (табл. 14).
Полного рассасывания опухолей при лечении экстрактом чистотела и тиофосфамидом не наблюдалось. В то же время при лечении амитозином даже в этот период отмечались случаи полного рассасывания опухолей у отдельных животных, хотя полное выздоровление обычно отмечается в более поздние после начала лечения сроки. При оценке эффективности амитозина через 22 дня после начала введения процент торможения обоих штаммов опухолей практически одинаков (9,7 % при саркоме МТХ и 96,66 % при карциноме Герена).
Гистологические изменения в опухолях после применения экстракта чистотела и тиофосфамида отличались от наблюдаемых при лечении животных амитозином. В опухолях животных, получавших экстракт чистотела, отмечалось интенсивное разрастание соединительной ткани, а после лечения тиофосфамидом преобладали явления распада опухолевой ткани.
При гистологическом исследовании опухолей животных, леченных тиофосфамидом через 10 дней после приготовления раствора, специфических изменений не обнаружено.
Лечение животных с саркомой МТХ и карциномой Герена экстрактом чистотела и тиофосфамидом сопровождается уменьшением содержания нуклеиновых кислот в опухолевых клетках, но в гораздо меньшей степени, чем в опытах с применением амитозина. Изменение активности альдолазы и церулоплазмина также менее выражено.
Заслуживает внимания направленность изменения количества лейкоцитов после применения составных частей амитозина. Лечение тиофосфамидом сопровождается выраженной лейкопенией. К концу курса введения препарата в периферической крови остается лишь 40 % лейкоцитов. Даже раствор тиофосфамида после длительного хранения вызывает заметную лейкопению, хотя препарат и теряет противоопухолевые свойства. В то же время экстракт чистотела приводит к повышению общего количества лейкоцитов на 30 %. Применение амитозина статистически достоверных изменений в количестве лейкоцитов не вызывает. Характерными оказались и изменения ферментов (табл. 15, 16).
Установлено химическое взаимодействие тиофосфамида и алкалоидов чистотела с образованием новых противоопухолевых веществ — тиофосфамидата суммы алкалоидов, а противоопухолевое действие амитозина не вызвано суммацией эффекта или потенцированием действия составляющих его компонентов. Характер химического взаимодействия амитозина выявлялся дальнейшими исследованиями.
В механизме действия амитозина отчетливо проявляется антимитотическое действие, свойственное алкалоидам чистотела, а также угнетение синтеза нуклеиновых кислот, свойственное алкилирующим препаратам, к которым принадлежит тиофосфамид. Несмотря на сходство в механизме действия между амитозином и входящими в его состав препаратами из группы антимитотических и алкилирующих агентов, противоопухолевое действие амитозина выражено в большей мере, чем у большинства из известных препаратов этих групп. Кроме того, амитозин обладает большей специфичностью противоопухолевого действия и в терапевтических дозах практически не влияет на функцию важнейших органов и систем, в том числе и кроветворение.
Эти свойства амитозина подтверждают целесообразность создания комплексных противоопухолевых препаратов, состоящих их активных веществ растительного и химического происхождения, т. е. принципиально новых фитохимических препаратов из группы алкалоидэтилениминов.
В связи с незначительной токсичностью и высокой противоопухолевой активностью амитозина, при получении которого использованы вещества, применяемые в медицинской практике и входящие в Государственную Фармакопею, препарат был рекомендован к клиническим испытаниям, которые проведены в ряде онкологических учреждений Украины в 1966—1967 гг.
В результате первой фазы предварительных клинических испытаний у инкурабельных больных злокачественными опухолями было отмечено отсутствие вредного действия амитозина на кроветворение и функцию важнейших органов и систем. Препарат применялся в основном в виде внутримышечных инъекций в дозе 1—3 мл каждые 5— 7 дней, 15—20 инъекций на курс. В отдельных случаях применяли его в виде изготовленной на смеси равных частей ланолина и вазелина 20%-й мази (при полипах и папилломах), а также ректально в форме свечей. При их изготовлении использовали 0,5 мл препарата на свечу: 0,3 г безводного ланолина и 2,5—3 г масла какао, свечи вводили дважды в день утром и вечером после туалета с интервалами между приемами 48 ч, 60 свечей на курс. Три курса лечения проводились с интервалами 1—3 мес. Отмечено раздражающее действие при парентеральном введении с образованием инфильтратов, а при повторном введении в зону — инфильтрата и абсцессов. В связи с этим врачи-клиницисты рекомендовали произвести очистку амитозина от балластных веществ. Киевским НИИ урологии препарат был признан эффективным при опухолях мочевого пузыря и простаты, а Киевским НИИ лор- болезней — при опухолях гортани и носа; урологическим отделением Ивано-Франковской горбольницы — при полипах уретры и аденомах простаты.
А.И.Потопальский
Препараты чистотела в биологии и медицине
|