5. ПРОДУКТЫ АЛКИЛИРОВАНИЯ ОЧИЩЕННОЙ СУММЫ АЛКАЛОИДОВ ЧИСТОТЕЛА ТИОФОСФАМИДОМ ...
ПРОДУКТЫ АЛКИЛИРОВАНИЯ ОЧИЩЕННОЙ СУММЫ АЛКАЛОИДОВ ЧИСТОТЕЛА ТИОФОСФАМИДОМ (ОЧИЩЕННЫЙ ОТ БАЛЛАСТНЫХ ВЕЩЕСТВ АМИТОЗИН) И ОТДЕЛЬНЫХ АЛКАЛОИДОВ
Известно, что амитозин — первый представитель нового класса химических веществ — алкалоидэтилениминов. В его составе содержится свыше 60 % тиофосфамидных производных алкалоидов протопиновой и хелидониновой групп (протопин, гомохелидонин, метоксихелидонин, хелеритрин), около 20—25 % производных алкалоидов группы берберина (берберин, коптизин), 15—20 % составляют тиофосфамидные производные алкалоидов группы сангвинарина и стилопина.
Проведенное экспериментальное изучение неочищенных образцов препарата подтвердило наличие у него противоопухолевой активности при таких моделях опухолей, как лимфосаркома мышей ЛИО-1, карцинома Герена, саркома МТХ. Предварительные клинические испытания амитозина, проведенные по решению Министерства здравоохранения Украины в 1966—1968 гг., свидетельствовали о его эффективности и целесообразности углубленного изучения у больных злокачественными опухолями шейки матки, яичников, грудной и поджелудочной железы, мочевого пузыря, простаты, гортани, а также при рецидивирующих полипах и папилломах уретры, носа, гортани, Клинические испытания подтвердили также необходимость проведенной в последующие годы очистки препарата от балластных веществ. После очистки амитозин подвергался повторному экспериментальному изучению.
При освоении производства опытных партий очищенного амитозина на Львовском химико-фармацевтическом заводе внедрена новая технология выделения очищенной суммы алкалоидов чистотела, используемых в дальнейшем для алкилирования тиофосфамидом.
5.1. ПОЛУЧЕНИЕ СУММЫ АЛКАЛОИДОВ ЧИСТОТЕЛА
Известны способы выделения алкалоидов из чистотела большого экстракцией спиртом, эфиром, водно-спиртовым раствором винно-каменной кислоты. Однако использование этой кислоты, этилового спирта и эфира в качестве растворителя усложняет технологический процесс.
Сотрудниками Львовского химико-фармацевтического завода В. М. Мусяновичем и А. С. Липковским в процессе освоения полузаводского регламента на получение препарата «амитозин» разработан упрощенный способ извлечения суммы алкалоидов чистотела.
В качестве органического растворителя используется ацетон, подкисленный уксусной кислотой, с последующей экстракцией выделившихся продуктов хлороформом. Первоначально траву чистотела большого экстрагируют ацетоном, содержащим 30 % (по объему) обессоленной воды, и подкисленным 0,5%-й уксусной кислотой. При экстрагировании ацетоном и подщелачивании концентрированным раствором аммиака до pH 10—11 выделяли алкалоид берберин. Затем основания алкалоидов, выпадающих в виде осадка, экстрагировали хлороформом. В результате стандартной обработки выделяют гидрохлорид хелидонина и определенное количество суммы алкалоидов, состоящей из сангвинарииа, хелеритрина, хелилютина и других алкалоидов.
Пример. В четыре перколятора загружают по 1,0 кг травы чистотела большого. Процесс экстрагирования сырья ведут противотоком. Экстрагентом является ацетон, содержащий 30 % (по объему) обессоленной воды, и подкисленный 0,5%-й уксусной кислотой. Настаивание в каждом перколяторе длится 8 часов. Экстракты с первых двух перколяторов объединяют и перерабатывают отдельно.
Третий, нормальный по содержанию экстрактивных веществ (экстракта 6,0 л), загружают в круглодонную колбу и на водяной бане отгоняют ацетон (4,0 л). Следы ацетона из водного кубового остатка отгоняют в вакууме. Водный кубовой остаток (2,0 л) переносят в 3-литровую коническою колбу и выдерживают при температуре 2—3°С 10—12 ч. При стоянии выделяется небольшое количество смол. Выдержанный водный раствор солей алкалоидов (прозрачный, густо вишневого цвета) сливают в чистую колбу и подщелачивают концентрированным раствором аммиака до pH 10—11. При этом часть оснований алкалоидов выпадает в виде обильного желто-коричневого хлопьевидного осадка. Основания алкалоидов извлекают экстракцией 13 г коричневого порошка (фракция алкалоидов группы берберина), который смешивают с 50 мл насыщенного водного раствора едкого натра и экстрагируют диоксаном (2X20 мл). Экстракт упаривают досуха и доочищают перекристаллизацией из спирта. Получают 1,16 г берберина, температура плавления 144—145°С (коричневатое окрашивание с хлорной водой). УФ-спектры: λmax 231, 265, 345 нм.
Хлороформное извлечение (6,0 л), содержащее основание алкалоидов, выдерживают 8—10 ч и отделяют небольшую водную фазу, а затем упаривают хлороформный раствор до 40—50 мл. Остаток переносят в чашку, прибавляют 10 мл воды и при перемешивании на кипящей водяной бане прибавляют 10%-й раствор соляной кислоты до pH водного раствора 3,0. Выпаривание продолжают до полного удаления хлороформа.
Водный раствор гидрохлоридов алкалоидов охлаждают, при этом выпадает около 3,26 г осадка, представляющего собой фракцию алкалоидов группы хелидонина (хелидонин, протопин, гомохелидонин, метоксихелидонин, хелеритрин, сангвинарин). Перекристаллизацией из воды получают 2,08 г гидрохлорида хелидонина в виде продукта с температурой плавления 295—296 °С, образующего с раствором гваякола в концентрированной серной кислоте темно-малиновое окрашивание.
Отфильтрованный водный раствор досуха упаривают на чашке. Полученный продукт измельчают в ступке и получают около 4,6 г алкалоидов (гидрохлориды в виде мелкодисперсного желто-коричневого порошка), или 0,416 % массы сырья.
Методом тонкослойной хроматографии на силакагеле в системе н-бутанол : уксусная кислота : вода (10 : 1 : 3) обнаружены: сангвинарин (Rf 0,44), хелеритрин (Rf 0,56), хелилютин (Rf 0,65).
5.2. СПОСОБ ПОЛУЧЕНИЯ ТИОФОСФАМИДНЫХ ПРОИЗВОДНЫХ АЛКАЛОИДОВ ИЗОХИНОЛИНОВОГО РЯДА ЧИСТОТЕЛА
Продукты алкилирования алкалоидов тиофосфамидов имеют следующую общую формулу:
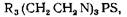
где R3 алкалоиды изохинонового ряда.
Эти соединения представляют собой микрокристаллический порошок желтоватого и светло-коричневого цвета, хорошо растворимый в диметилсульфоксиде, диметилформамиде, хлороформе и других органических растворителях, трудно растворимый в воде.
С целью их получения исходные продукты — тиофосфамид и отдельные алкалоиды изохинолинового ряда или их сумму приводили во взаимодействие в среде органического растворителя при температуре кипения. При этом происходил аминолиз этилениминных циклов тиофосфамида с образованием целевых продуктов.
Алкалоиды, относящиеся к четвертичным аммонийным основаниям (такие как берберин, сангвинарин, оксисангвинарин, коптизин и др.), реагируют как аминоспирты, так как процесс проводят в безводной среде. Например, алкалоид берберин в безводной среде называется берберинолом.
В процессе взаимодействия указанные алкалоиды, как аминоспирты, подвергают тиофосфамид реакции аминолиза, т. е. расщеплению этилениминных циклов с образованием внутриионных соединений.
Полученные в результате реакции взаимодействия целевые продукты выделяли путем отгонки растворителя из реакционной смеси, отмывки непрореагировавших исходных продуктов и перекристаллизации целевого продукта.
5.2.1. Получение продукта взаимодействия суммы алкалоидов чистотела с тиофосфамидом (очищенный препарат амитозин). Пример получения препарата: 3,5 г алкалоидов, выделенных из чистотела большого (331 моль), и 3,8 г (20,1 ммоль) тиофосфамида растворяли в 60 мл хлороформа и кипятили в колбе с обратным холодильником в течение 2 ч.
Продукт реакции обецвечивали активированным углем и отгоняли растворитель. Сухой остаток тщательно промывали эфиром для удаления непрореагировавших исходных веществ. Получили 1,45 г целевого продукта светло-коричневого цвета, хорошо растворимого в хлороформе, диметилсульфоксиде, смеси диметилсульфоксида и полиэтиленгликоля-400, диметилформамиде, трудно растворимого в воде и эфире. Выход 34,5 %.
Вычислено, %: 2,86; 7,50. Найдено, %: 2,82; 7,60.
5.2.2. Получение сангвинарин-тиофосфамида. 7,5 ммоль сангвинарина (Тпл 267 °С) и 14,27 ммоль тиофосфамида растворяли в 700 мл бензола и смесь кипятили в колбе с обратным холодильником в течение 2 ч. Полученную смесь обесцвечивали активированным углем и отгоняли растворитель. Сухой остаток промывали тщательно эфиром для удаления непрореагировавших исходных веществ. Получали 1,5 г три- (N-сангвинаринол) —этиламида тиофосфорной кислоты, представляющего собой желтоватый кристаллический порошок, хорошо растворимый в бензоле, хлороформе, диметилформамиде, дихлорэтане, труднорастворимый в воде, растворимый при нагревании в 10%-й соляной кислоте, нерастворимый в метаноле и эфире. Выход составляет 50,8 % от теоретического.
Температура плавления (из смеси хлороформа и метанола) 189—191 °С. Максимум поглощения: 238, 338, 398 и 407 нм.
5.2.3. Получение берберин-тиофосфамида. 8,86 ммоль, берберина-основания и 13,5 ммоль тиофосфамида кипятили в 600 мл безводного диоксана в колбе с обратным холодильником в течение 2 ч. Полученную смесь обесцвечивали активированным углем и отгоняли растворитель под вакуумом при 10 мм рт. ст. Сухой остаток промывали эфиром, хлороформом и получали 3,3 г ди- (этиленимио)-берберинолэтиламида тиофосфорной кислоты, который представляет собой темно-желтый кристаллический порошок, хорошо растворимый при нагревании в соляной кислоте, труднорастворимый в обычных органических растворителях. Выход составляет 97 % от теоретического. Температура плавления (из смеси бензола и диметилсульфоксида) 135 °С.
5.3. ТОКСИЧНОСТЬ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ ОЧИЩЕННОГО АМИТОЗИНА
5.3.1. Острая токсичность. Токсичность очищенного варианта амитозина несколько увеличилась, а фармакологические эффекты соответствуют по направленности таковым для неочищенного препарата.
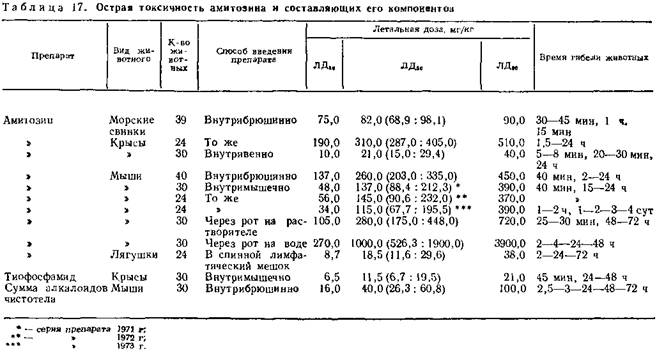
Проявления острой токсичности у теплокровных животных при внутрибрюшинном и внутримышечном введении препарата выражались повышенной двигательной активностью, сменяющейся общей заторможенностью, судорожными подергиваниями конечностей, частым прерывистым дыханием. Смерть наступала от остановки дыхания. Продолжительность указанных явлений с момента введения смертельных доз составляет 10—60 мин (табл. 17).
Проявления острой токсичности у различных видов животных свидетельствуют о специфичности действия препарата. Наиболее чувствительными к нему среди теплокровных оказались морские свинки.
Отдельные серии препарата имеют незначительные отличия в токсичности. При вскрытии погибших животных в брюшной полости был выявлен светлый эксудат, отчетливо выражена инфильтрация сосудов брыжейки и брюшины. В легких наблюдались множественные мелкоочаговые кровоизлияния, остановка сердца происходила в диастоле.
Несколько иная картина отравления у холоднокровных животных. Явления отравления у лягушек выражались через 15—20 мин после введения препарата полной потерей двигательной активности, отсутствием реакции на болевое раздражение и остановкой дыхания при сохранении сердечной деятельности. Гибель животных наступала в течение 30—120 мин.
Острая токсичность амитозина зависит от скорости его поступления в организм. При внутривенном введении смерть наступает в первые минуты, а при оральном — через несколько суток. ЛД50 при внутривенном введении почти в 15 раз ниже, чем при внутрибрюшинном. Этот факт подтверждается также значительными отличиями ЛД50 при оральном введении препарата в виде раствора и водной взвеси. При вскрытии в лимфатическом мешке и брюшной полости лягушек обнаружен светлый эксудат, в легких — единичные точечные кровоизлияния.
Результат определения ЛД50 амитозина свидетельствует о высокой чувствительности к нему лягушек и незначительной токсичности для крыс и мышей. Токсичность амитозина при внутримышечном введении для мышей почти вдвое выше, чем при внутрибрюшинном. При сравнении острой токсичности препарата с суммой алкалоидов чистотела и тиофосфамидом, используемыми при его получении, амитозин оказался в несколько раз менее токсичен, чем составляющие его компоненты.
Наряду с этим изучались токсические свойства амитозина для собак с установлением переносимых доз в острых опытах при внутрибрюшинном введении.
Абсолютно смертельной для собак оказалась доза 60 мг/кг. Через несколько минут после введения препарата заметно нарушалась координация движений: шатающаяся походка, животное периодически ложилось на пол и сразу же вставало. Через 7 мин отмечено боковое положение, затрудненное редкое дыхание, ослабленная реакция на болевое и звуковое раздражение, общее состояние угнетенное. Через 30 мин и спустя 2 ч после введения наблюдалась рвота. Общее состояние животного продолжало оставаться резко угнетенным — дыхание прерывистое, с остановками в пределах минуты, явления опистотонуса, челюсть отвисала при явлениях обильной саливации. Реакция на болевое раздражение была резко ослаблена. Собака погибла через 5 ч от остановки дыхания. При сравнении исходных показателей периферической крови с предагональным периодом отмечались лейкоцитоз (22 400 лейкоцитов против 10 800 в норме), лимфоцитоз (45% против 22%), количество палочкоядерных и сегментоядерных форм лейкоцитов незначительно уменьшалось. Со стороны биохимических показателей в крови следует отметить заметное повышение содержания сахара (19,2 % против 120 мг%), креатинина и мочевины (в среднем в 2 и 3 раза).
Введение препарата собаке в дозе 40 мг/кг приводило через 15 мин к выраженному двигательному беспокойству: животное металось по клетке, почесывало лапами морду. Дыхание было резко учащенным. Постепенно наступало успокоение и состояние его стало угнетенным, положение тела боковое, дыхание затруднено. Через 30 мин появились кленическне судороги, которые каждые 3—4 мин повторялись. Реакция на болевое и звуковое раздражение в это время резко ослаблена. Через 2—3 ч судороги прекращались, общее состояние значительно улучшилось и через 24 ч было удовлетворительным, признаки токсического действия препарата не проявлялись. Собака погибла на 20-й день после введения препарата.
В периферической крови отмечалось незначительное увеличение количества лейкоцитов, лимфоцитов, моноцитов и тромбоцитов, со стороны биохимических показателей, как и у предыдущей собаки, повышалось содержание мочевины, креатиннна и сахара в крови.
Доза 20 мг/кг амитозина при внутрибрюшинном разовом введении собакам оказалась переносимой без значительных признаков токсического действия, наблюдались только почесывание морды и встряхивание туловищем.
Животное находилось под наблюдением в течение месяца, общее состояние оставалось удовлетворительным.
Наблюдаемые изменения в периферической крови имели аналогичный характер с предыдущим опытом. Проведенный в конце курса введения анализ миелограммы свидетельствует об отсутствии угнетающего действия амитозина на кроветворение.
Кроме того, амитозин в дозе 12 мг/кг вводился внутривенно кошкам. Картина острого токсического действия препарата была сходной с описанной у собак. Через одну минуту после инъекции животное принимало боковое положение, наблюдалась выраженная одышка, а через 2—3 мин животное вставало. Координация движений оставалась нарушенной, шаткая походка, лапы расползаются в стороны, покачивание туловищем и головой, выраженная саливация. Реакция на болевое раздражение резко ослаблена, корнеальные рефлексы сохранены, зрачки расширены, крик хриплый. На 8—10 мин слюноотделение прекратилось, но периодически отмечались явления опистотонуса. Постепенно в пределах 1,5—3 ч состояние животного нормализовалось. Реакция на болевое и звуковое раздражение возобновилась. Общее состояние в течение 30 дней наблюдения было удовлетворительным.
Патоморфологическим исследованием внутренних органов (печень, почки, миокард, легкие, селезенка, надпочечники, щитовидная железа) собаки, погибшей от абсолютно смертельной разовой дозы амитозина (60 мг/кг), заметных изменений их структуры не обнаружено.
При исследовании морфологии внутренних органов собаки, получившей переносимую дозу амитозина (20 мГ/кг), спустя месяц обнаружены выраженные изменения в печени: явления белково-жировой дистрофии; полнокровие ткани, диапедезные кровоизлияния.
В миокарде заметны изменения по типу зернистой дистрофии, в надпочечниках — гипертрофия клеток клубочковой зоны. В других органах отмечались только явления полнокровия.
5.3.2. Хроническая токсичность амитозина. Влияние длительного введения амитозина изучено на мышах, крысах, морских свинках и собаках. Длительное введение амитозина собаке проводилось в субтоксической дозе 20 мг/кг внутрибрюшинно — 13 ежедневных инъекций на курс (табл. 18).
Длительное введение амитозина собаке приводило сначала к выраженному лейкоцитозу, а затем к умеренной лейкопении, снижалось также содержание эритроцитов.
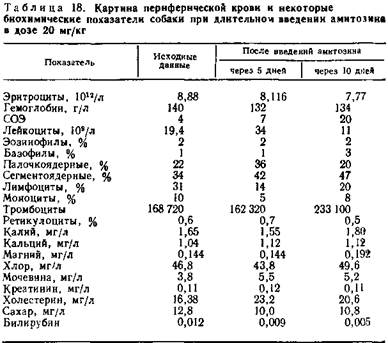
Увеличивалось содержание калия, холестерина и мочевины в крови. После 10 инъекций общее состояние животного ухудшалось появлялась общая вялость, адинамия, потеря аппетита. Собака резко теряла массу (7 кг 100 г — 4 кг 800 г), после тринадцатой инъекции препарата состояние животного резко ухудшалось и через день оно погибало.
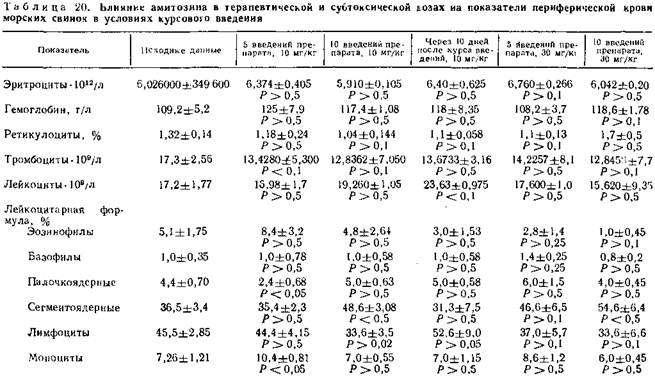
Влияние длительного введения препарата более углубленно изучено на морских свинках. Амитозин вводился внутрибрюшинно ежедневно в течение 10 дней в дозе 1/3 и 1/3 ЛД50. В группе с введением токсической дозы 50 мг/кг после 4—5 инъекций большинство животных погибло. Динамика показателей периферической крови морских свинок в условиях курсового введения терапевтической и субтоксической доз амитозина представлена в табл. 19.
Приведенные данные свидетельствуют об отсутствии у амитозина лейкопенического эффекта, характерного для большинства известных противоопухолевых химиопрепаратов. Не отмечено также влияния его на содержание эритроцитов, ретикулоцитов, гемоглобина и тромбоцитов.

После курса введений в дозе 10, 30 мг/кг наблюдается статистически достоверное увеличение процентного содержания сегменто-ядерных лейкоцитов и уменьшение количества лимфоцитов на 11,9% к исходному. Через 10 дней после окончания курса введений в дозе 10 мг/кг изучаемые показатели нормализуются и даже наблюдается лейкоцитоз. В аналогичных условиях опыта с дозой 30 мг/кг сохраняется увеличение сегментоядерных форм. Микроскопическая картина крови на мазках, окрашенных по Паппенгейму, после применения амитозина не отличается от таковой в контроле. Исследование мазков — отпечатков костного мозга после курсового применения амитозина не выявило каких-либо особенностей микроскопической картины по сравнению с контролем.
Дифференциальным подсчетом клеток костного мозга интактных контрольных животных показано соответствие миелограммы с литературными данными. После курса введений амитозина в разовой дозе 10 мг/кг в мазках костного мозга наблюдаются статистически достоверное увеличение количества палочкоядерных нейтрофильных лейкоцитов, уменьшение числа эозинофильных миелоцитов и метамиелоцитов. Через 10 дней после окончания курса количество указанных форм нормализуется, но при этом наблюдается уменьшение количества проэритробластов и полихроматофильных нормобластов. Курсовое применение амитозина в субтоксических дозах привело к некоторому снижению числа палочкоядерных нейтрофилов при разовой дозе 30 мг/кг и к увеличению процентного содержания сегментоядерных нейтрофилов при разовой дозе 50 мг/кг.
В периферической крови в это же время отмечается нейтрофилез (см. табл. 19).
Результаты парциального анализа миелограммы в условиях курсового применения амитозина представлены в табл. 20.
Отмечается увеличение лейкоэритробластического соотношения и костно-мозгового индекса нейтрофилов через 10 дней после окончания курса введений амитозина в разовой дозе 10 мг/кг, сопровождающееся выраженным лейкоцитозом в периферической крови. В другие сроки наблюдений при применении различных по величине доз амитозина отклонения в функциональном состоянии костного мозга не отмечаются.
Гистологическое исследование препаратов костного мозга, приготовленных из декальцинированной бедренной кости, не выявило каких-либо изменений под влиянием курсового введения амитозина даже в дозе 50 мг/кг.
Микроскопическим исследованием селезенки морских свинок, подвергшихся курсовому воздействию амитозина в терапевтической и субтоксической дозах, выявлена нормальная структура этого органа с четко сформированными фолликулами. Встречаются клетки в состоянии митотического деления. Никаких признаков деструкции лимфоидных клеток или обеднения клеточного состава органа выявить не удалось. Отмечается только более выраженный гемосидероз селезенки.
При подсчете количества миелокариоцитов в 1 мм3 костного мозга грудины морских свинок после курса введения амитозина в дозе 10, 30 мг/кг статистически достоверных измерений не обнаружено (1190700± 11500 у интактных животных против 1287400 ± 97000 и 1003300 ± 93000 в опытных группах).
При патоморфологическом исследовании внутренних органов собаки, погибшей после 13 инъекций амитозина, обнаружены дистрофические изменения в печени и почках. В печени наблюдаются жировое перерождение клеток, полнокровие ткани, кровеизлияния, а в почках умерено выражены зернисто-белковая дистрофия эпителия извитых канальцев, десквамация клеток эпителия, полнокровие клубочков и дилятация капилляров. В легких отмечалось полнокровие ткани, в селезенке — явления амилоидоза. Структуры остальных органов (сердце, надпочечники и др.) не изменялись.
В органах морских свинок, забитых после 10 инъекций амитозина в дозе 10 мг/кг, были отмечены явления полнокровия, признаки зернистой дистрофии в печени, почках и миокарде, дистрофические изменения в пучковой и сетчатой зонах надпочечников, утолщение межальвеолярных перегородок в легких.
Остальные органы (кишечник, селезенка, половые железы, щитовидная железа) не изменялись.
Аналогичные по направленности, но менее выраженные морфологические изменения внутренних органов наблюдались и у морских свинок, забитых через 10 дней после 10 инъекций амитозина в дозе 10 мг/кг. В группе морских свинок, которым препарат вводился в дозе 30 мг/кг в течение 10 дней, морфологические изменения во внутренних органах существенно не отличались от описанных выше. Место введения препарата характеризуется наличием созревающей грануляционной ткани с незначительным количеством остатков препарата.
При патоморфологическом исследовании внутренних органов мышей и крыс, погибших от токсических доз, отмечено наличие дистрофических изменений, которые чаще всего наблюдаются в печени, почках, сердце, легких. В печени нарушается четкость структуры органа, имеются дегенеративные изменения протоплазмы и ядер клеток. В почках особенно выражены дистрофические изменения в канальцах с явлениями усиленного слущивания эпителия. В корковом слое надпочечников заметна гиперплазия. В легких отмечается расширение альвеол, разрывы их стенок, очаговые кровоизлияния и диапедез форменных элементов крови.
При длительном введении терапевтических доз препарата описанные изменения структуры внутренних органов слабо выражены или не обнаружены. Спустя один — полтора месяца после окончания введения изменения структуры органов не выявились. Только при введении токсических доз амитозина отмечается гиперплазия коркового слоя надпочечников. В щитовидной железе структурных изменений не обнаружено.
Хроническая токсичность амитозина на крысах изучена при аналогичном терапевтическому курсу введении в максимально переносимой разовой дозе, равной 100 мг/кг, вводимой внутрибрюшинно пятикратно. За время введения животные несколько потеряли в весе (118 + 2,3 против 124; Р<0,05), но общее состояние их не изменилось.
В конце курса наблюдались увеличение количества эритроцитов, повышение СОЭ, незначительное снижение количества лейкоцитов и содержания гемоглобина, однако в дальнейшем происходит их нормализация. Через 1,5 мес. наблюдения существенных отличий периферической крови, за исключением относительной лимфопении, не обнаружено. Отмечено снижение скорости свертывания крови (8 мин±0,7 против 5±0,5 в норме; /’<0,001).
Кумулятивные свойства препарата изучались в опытах на мышах при внутримышечном введении. Индекс кумуляции для амитозина равен по Личфилду и Уилкоксону 0,2; по В. А. Чернову — 2,2. Индекс обратимости при десятикратном введении, вычисленный по формуле Л. Ф. Ларионова, составляет —7,1; что свидетельствует о том, что при той же степени токсичности за 10-дневный курс можно ввести в 7 раз больше препарата, чем о нократно.
5.3.3. Влияние на центральную и периферическую нервную систему. Влияние амитозина на ЦНС (тройной аналитический тест) изучено на мышах при введении препарата в дозах: 60, 120, 240, 480, 360 мг/кг. При дозе 240 мг/кг наблюдалась повышенная активность на электрическое раздражение. В дозе 480 и 960 мг/кг через 15—20 мин отмечалось общее двигательное беспокойство, которое в дальнейшем сменялось угнетением двигательной активности.
Результаты изучения влияния препарата на периферические нервные структуры изолированных органов свидетельствуют о наличии у него выраженного антигистаминного, папавериноподобного и местноанестезирующего действия.
Амитозин не вызывает сокращения семенного канатика, но несколько ослабляет реакцию его на адреналин. Через 30 мин после инъекции препарата морским свинкам наступает полная анестезия кожи в месте введения. Аналогичный результат получен при введении амитозина в конъюнктивальный мешок глаза кролика. Анестезия сохраняется 30—40 мин.
Через 30 мин после введения лягушкам в лимфатический мешок 1 мг/кг амитозина обнаружены признаки курареподобного действия: полная обездвиженность, выключение дыхания при сохранении сердечной деятельности,
5.3.4. Влияние на сердечно-сосудистую систему. В опытах на изолированном сердце лягушки амитозин вызывает заметное изменение ритма сердечных сокращений в виде брадикардии, аритмии, а затем полной атривентрикулярной блокады. Сила сердечных сокращений изменяется незначительно.
Из-за плохой растворимости препарата «амитозин» в ограниченном количестве растворителя (2 мл) внутривенное введение концентрированных растворов вызывает гибель животного (кошки и кролика). Поэтому действие амитозина на артериальное давление изучалось в острых опытах на кошках под тиопенталовым наркозом (50 мг/кг внутрибрюшинно). Препарат вводили в бедренную вену в дозе 12,5 мг/кг/мл растворителя. Введение препарата приводило к кратковременному снижению артериального давления (в среднем на 60—70 мм рт. ст.). Возврат к исходным величинам наступал через 2—5 мин. Во время введения препарата отмечались учащение и уменьшение глубины дыхательных движений. На фоне действия амитозина наблюдалось незначительное снижение реакции на введение адреномиметиков и ацетилхолина.
Сумма алкалоидов чистотела большого в дозе 25 мг/кг при внутривенном введении кошке приводила к резкому падению артериального давления и гибели животного от остановки дыхания. При дозе 12,5 мг/кг артериальное давление снижалось на 40—50 мм, а на 6—7-й минуте нормализовалось. На фоне действия суммы алкалоидов чистотела отмечалось снижение артериального давления при введении адренэргических веществ.
Влияние амитозина на ЭКГ-показатели изучалось при одно- и многократном введении на собаках, кошках, кроликах и крысах. Однократное введение амитозина в дозах 20 и 40 мг/кг собакам не вызывало существенных изменений показателей ЭК. Длительное введение амитозина в дозе 20 мг/кг приводило к увеличению вольтажа зубца Р, некоторому смещению и увеличению вольтажа зубца Т; заметного изменения ритма сердечных сокращений не наблюдалось.
У кроликов и крыс амитозин вызывал увеличение силы сердечных сокращений и незначительно урежал их ритм. При однократном введении указанные изменения носят обратимый характер и через 48—72 ч исчезают. При многократном введении терапевтических доз амитозина значительных изменений ЭКГ-показателей не наблюдалось.
Влияние амитозина на эндокринную систему учитывалось по морфологическим изменениям в щитовидной железе, надпочечных и половых железах. Только при введении токсических доз амитозина отмечалась гиперплазия коркового слоя надпочечников. В щитовидной железе заметных изменений структуры не обнаружено.
5.3.5. Влияние амитозина на некоторые показатели реактивности. В связи с многочисленными исследованиями иммунодепрессивных свойств противоопухолевых веществ и их угнетающего действия на показатели реактивности нами проведено изучение влияния амитозина на реактивность интактных и опухолевых крыс. Параллельно изучено действие тиофосфамида. Препараты вводились в терапевтических дозах курсами из 5 инъекций. В качестве показателей реактивности избраны фагоцитарная активность лейкоцитов периферической крови, канцеролитические свойства сыворотки крови.
Установлено, что амитозин у интактных животных в большинстве случаев несколько угнетает показатели реактивности. У опухолевых животных на фоне резкого снижения этих показателей введение препарата приводит к их заметному увеличению, а иногда и к полной нормализации. Указанная закономерность наиболее отчетливо видна при изучении канцеролитических свойств сыворотки крови и фагоцитарного индекса.
Процент фагоцитированных нейтрофилов определяли из 100—200 клеток, а фагоцитарный индекс — путем подсчета среднего числа бактерий, поглощенных одним активным фагоцитом.
Влияние на течение анафилактического шока. В двух сериях на 16 морских свинках вводили амитозин на фоне их сенсибилизации лошадиной сывороткой. При внутри венном введении разрешающей дозы сыворотки животным, получавшим амитозин, явления анафилактического шока наступали у них позже, чем у контрольных, и увеличивалась продолжительность жизни. Двое из восьми животных опытной группы выжили, что может свидетельствовать о некотором десенсибилизирующем влиянии амитозина.
5.3.6. Определение местного (раздражающего) действия. Местная реакция на применение амитозина зависит от пути его введения. При внутримышечном введении препарата иногда отмечаются инфильтрация и локальная гиперемия кожи, которая в течение непродолжительного времени исчезает. Подкожное и внутрикожное введение концентрированных растворов амитозина сопровождается на 5—7-й день некротическими изменениями кожи на месте инъекции, поэтому введение должно быть строго внутримышечным. Введение ректально в форме свечей и применение мази с амитозином изменений на коже и слизистых не вызывает. В связи с этим, в случае наличия местных реакций при внутримышечных инъекциях, возможно ректальное применение препарата.
Выявлено, что амитозин относится к числу противоопухолевых препаратов со сравнительно низкой токсичностью и незначительным действием на структуру и функцию жизненно важных органов и систем. Учитывая большую широту терапевтического действия амитозина, отсутствие аллергизации организма и угнетения гемопоэза, не следует опасаться серьезных осложнений при клинических испытаниях препарата.
А.И.Потопальский
Препараты чистотела в биологии и медицине
|