5.5. ОСОБЕННОСТИ МЕХАНИЗМА ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ АМИТОЗИНА
5.5.1. Гистологические и гистоцитохимические изменения в опухолях. При изучении особенностей действия препарата на опухоль и организм использованы морфологические, гистохимические, биохимические методы, изучены сосудисто-тканевая проницаемость и кровоснабжение, собственная люминесценция амитозина. В отдельной серии опытов определено его влияние на показатели реактивно ги.
Гистологические и гистохимические изменения прослежены в динамике процесса торможения роста и регрессии опухолей при различных экспериментальных моделях опухолей животных (карцинома Герена гепатома РС-1, опухоль яичников ОЯ, карцинома Эрлиха, саркома Крокера). Параллельно с амитозином изучалось действие тиофосфамида. Установлено, что первые инъекции амитозина сопровождаются появлением деструктивных явлений в клетках зоны роста новообразований. Часть клеток вакуолизируется, повреждаются ядерные оболочки и ядерное вещество оказывается свободно лежащим в цитоплазме или внеклеточно после разрушения протоплазматической оболочки. Полностью угнетается митотическая активность опухолевой ткани, появляются гигантские клетки. В дальнейшем эти изменения прогрессируют и особенно выражены в зонах интенсивной васкуляризации, а также в участках, массивно инфильтрованных лимфоцитами. Постепенно нарастает количество гигантских клеток, которые достигают 30—35 мкм.
При введении тиофосфамида количество гигантских клеток незначительно. Отдельные клетки достигают в диаметре 65 мкм. В конце курса лечения в большинстве гистологических препаратов жизнеспособные раковые клетки не обнаруживаются, а на месте бывшей опухоли развивается коллоидный рубец.
В начале процесса регрессии опухолей количество РНК в опухолевых клетках возрастает. В дегенерирующих клетках содержание РНК падает и в конце процесса регрессии сохраняется только в отдельных дистрофически измененных гигантских клетках, замурованных в разросшейся соединительной ткани. В процессе химиотерапии содержание ДНК в опухолевых клетках прогрессивно снижается соответственно выраженности глыбчатого дегенеративного распада ядерной оболочки и ядерного вещества, которые в дальнейшем лизируют.
Активность кислой фосфатазы в ядрах опухолевых клеток повышается, особенно в тех клетках, ядра которых пикнотизируются. Щелочная фосфатаза так же, как и в контрольных опухолях, определяется только в соединительных элементах. В процессе химиотерапии гистотопография энзима не изменяется, однако активность его значительно повышается.
Введение противоопухолевых препаратов сопровождается значительным усилением реакции на сукцинатдегидрогеназу. Характерен полиморфизм гранул диформазана, свидетельствующий о повреждении митохондрий опухолевых клеток. Значительно повышается активность α-глицерофосфатдегидрогеназы, глюкозо-6-фосфатдегидрогеназы, ДПН-диафоразы и цитохромоксидазы.
Процесс регрессии опухолей сопровождается фиброзом, заключающимся в синтезе коллагена активированными фибробластами и коллагенизации аргирофильной сети опухолевой ткани.
Таким образом, регрессия экспериментальных опухолей под действием амитозина и тиофосфамида характеризуется непосредственным влиянием препаратов на опухолевые клетки, что проявляется возникновением значительных деструктивных и дистрофических изменений. При этом наблюдается повреждающее действие препаратов на клеточные нуклеопротеиды, а также митохондриальные и лизосомальные структуры, сопровождающиеся значительным высвобождением катаболистических и окислительно-восстановительных энзимов. Действие амитозина и тиофосфамида качественно проявляется однотипными изменениями, выраженность которых больше в опытах с применением амитозина.
В опытах с применением предложенных нами методов изучения процессов дифференциации и специализации клеток установлено, что амитозин вызывает не только дегенеративные изменения опухолей, но и, по-видимому, способствует дифференциации некоторой части опухолевых клеток. Об этом свидетельствует резкое увеличение количества эозинофилов в клеточном составе гемоцитобластоза Швеца.
В то же время амитозин в физиологических концентрациях (1 : 1000; 1 : 10 000) не влияет на рост и специализацию клеток.
Методом радиоизотопной индикации с помощью радиоактивного фосфора установлено, что при введении противоопухолевых препаратов отмечается изменение проницаемости биологических барьеров. Под влиянием введения интактным и опухолевым животным тиофосфамида и амитозина в 1,5—2 раза увеличивается проницаемость таких специализированных барьеров, как гематоофтальмический и гематоэнцефалический, а также гисто-гематических барьеров почти всех обследованных органов, за исключением лимфатических узлов и скелетной мышцы. Интересно отметить, что при введении амитозина процент включения радиофосфора в опухоль на 40—50 % выше, чем в опытах с тиофосфамидом.
Изучение кровоснабжения опухоли методом контрастной ангиорентгенографии показало усиление ее сосудистого рисунка в первые 2 часа после введения амитозина, что совпадает с повышением радиоактивности опухолевой ткани.
В опытах на крысах с помощью биохимических методик изучено влияние амитозина на тканевое дыхание, некоторые звенья обмена углеводов и на содержание метал лопротеидов.
Амитозин резко увеличивает потребление кислорода опухолевой тканью. Аналогичная тенденция отмечается и по отношению к ткани печени и сердца (разница статистически не достоверна). Содержание 0,2—2 мкг/мл препарата в пробе стимулирует потребление кислорода. Более высокие концентрации проявляют угнетающее действие, выраженность которого возрастает по мере увеличения концентрации. С целью подтверждения свойства препарата усиливать аэробную фазу тканевого дыхания предпринято изучение его действия на некоторые звенья углеводного обмена,
В печени животных как в контроле, так и после введения амитозина отмечаются значительные изменения содержания углеводов по сравнению с таковыми у интактных животных.
Так, в печени интактных крыс после введения амитозина наблюдается высокий уровень гликогена и в то же время происходит значительное снижение содержания глюкозы, фруктозо-фосфата, фруктозо-1,6-дифосфата, неорганического фосфора, суммы пентоз, адениловых соединений. После введения амитозина в печени опухолевых животных отмечены значительные изменения содержания гликогена и глюкозы, нормализуется уровень фруктозы, креатинфосфата.
Результаты изучения тех же показателей в опухолевой ткани гепатомы РС-1 подтверждают влияние амитозина на уровень гликогена и глюкозы, количество которых возрастает в 2—3 раза по сравнению с контролем, происходит уменьшение таких фосфорных соединений, как креотинфосфат, сумма АТФ и АДФ, глюкозо-6-фосфат.
Наибольшая активность амитозина обнаружена при ранних сроках начала лечения в максимальных терапевтических дозах при 5—10-кратном введении его с интервалами 24—48 ч. Выраженное терапевтическое действие характерно также при резистентных к тиофосфамиду опухолях. Существенных изменений массы внутренних органов у подопытных животных под влиянием амитозина не наблюдалось.
В этих опытах критерий достоверности определялся у контрольных животных по отношению к интактным, а у опытных мышей — по отношению к контролю.
Длительное введение терапевтических доз препарата не вызывает выраженных изменений структуры внутренних органов. Наблюдаются лишь слабо выраженные дистрофические изменения по типу белковой и жировой дистрофии печени и почек.
Амитозин также влияет на содержание металлопротеидов сыворотки крови: церулоплазмина и трансферрина, относящихся к глюкопротендам, вызывая тенденцию к нормализации их количества.
При этом в опухолевых тканях отмечается повышение кондазной активности.
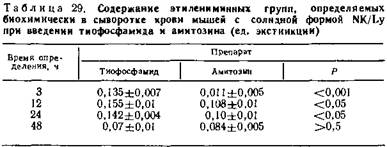
5.5.2. Тропизм амитозина к опухолевой ткани. Содержание этилениминных групп в биологическом материале после введения амитозина. С целью определения избирательности действия препарата в организме проведена серия исследований по изучению органотропности этилениминных групп на животных, которым вводили тиофосфамид и амитозин. Материалом исследований служили: сыворотка крови, печень и опухолевая ткань мышей при солидной форме лимфомы NK/Ly.
Контрольную группу составили животные, которым вводили однократно тиофосфамид в дозе 30 мг/кг, а опытным — амнтозии в дозе 100 мг/кг. Животных обеих групп забивали методом цервикальной дислокации через 3,12, 24 и 48 часов после введения препаратов (табл. 29, 30).
Установлено, что максимальное содержание этилениминных групп в крови мышей в опытах с тиофосфамидом определяется через 3—12 ч после введения и сохранения на одном уровне до 24 ч, а затем резко падает. Для амитозина максимальное количество этилениминных групп удалось определить в сыворотке крови через 12—24 ч. Однако количество их несколько ниже, чем у животных, которым вводился тиофосфамид. Через 48 ч у животных обеих групп в сыворотке крови определяются лишь следы этилениминных групп.
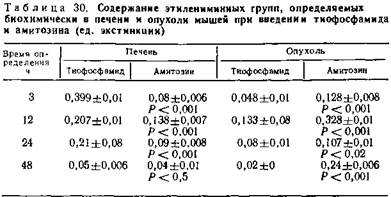
Определялись этилениминные группы в печени и опухолевой ткани животных, получавших тиофосфамид и амитозин (табл. 30, 31).
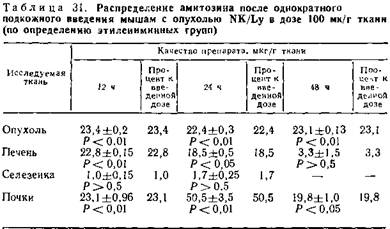
Результаты исследований показывают, что амитозин обладает более высокой онкогенной избирательностью действия, поскольку этилениминные группы максимально накапливаются в опухоли. У тиофосфамида были более выражены панкреатропные свойства. Касаясь динамики определения этилениминных групп в органах, следует отметить, что максимальное количество этилениминных групп при введении тиофосфамида обнаруживается в печени через 3 ч после введения препарата и сохраняется на относительно высоком уровне до 24 ч с момента введения, превышая в несколько раз их концентрацию в опухолевой ткани.
В опытах с амитозином содержание этилениминных групп в печени даже через 12—24 ч после введения было в два раза ниже, чем у животных, получивших тиофосфамид. В то же время концентрация их в опухоли в несколько раз выше, чем в печени и сыворотке крови, и сохраняется на высоком уровне до 48 ч.
Люминесцентный метод изучения тропизма амитозина к опухолевой ткани. Нами изучены: время проникновения амитозина, зависимость между наличием и интенсивностью люминесценции раковых клеток после контакта с препаратом, а также их способность к последующей перевивке животных. С этой целью использовались чувствительные к препарату гемобластозы Швеца и малочувствительная опухоль яичников (ОЯ). Установлено, что инкубирование опухолевых клеток гемоцитобластоза Швеца в среде с препаратом приводило к появлению в них люминесценции уже в течение первых 20—30 мин контакта.
К 3 ч свечение клеток отличается значительной интенсивностью. Особенно ярко люминесцируют ядра. При разведении амитозина 1 : 1000 возникает сплошной фон свечения препарата в среде, который наслаивается на люминесценцию раковых клеток. После отделения их от инкубационной среды и отмывания стерильным физиологическим раствором для удаления несвязывающегося с клетками препарата их люминесценция характеризовалась яркостью и контрастностью.
Трансплантация животным клеток в стерильном физиологическом растворе дала отрицательный результат. Опухоль не развивалась ни при внутрибрюшинной, ни при подкожной трансплантации. При этом в первые дни после подкожной имплантации на месте введения образуются маленькие плотные узелки размером не более 0,3X0,3X0,3 см, которые через 3—4 дня полностью исчезали. В контроле к этому времени опухоли достигали размеров в среднем 6 см3.
Инкубирование в тех же условиях опухолевых клеток рака яичника люминесценции у них не вызывало. При имплантации их животным не выявлено торможения роста опухоли по сравнению с контролем.
Амитозин в дозе 100 мг/кг, введенный под кожу крысам с опухолью гемоцитобластоза, вызывает люминесценцию опухолевых клеток только после 4 ч. Следует отметить, что интенсивность свечения после подкожного введения соответствующих доз препарата меньше, чем при внутрибрюшинном введении.
Повторные подкожные инъекции значительно усиливают люминесценцию. Изучение накопления амитозина после экстракции из опухолевой ткани и флюориметрии на спектрофлюориметре свидетельствует о преимущественном выявлении его в опухолевой ткани.
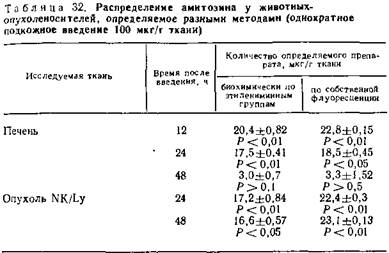
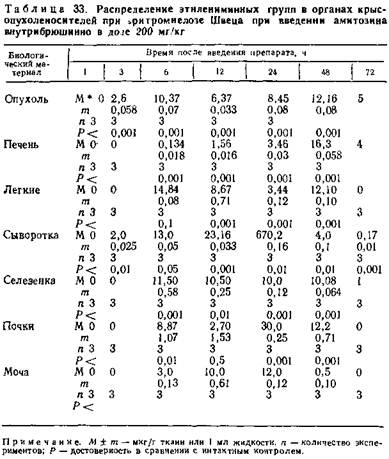
5.5.3. Фармакодинамика амитозина при различных способах введения. Для эффективного лечебного действия препарата необходимо наличие активных реакционноспособных группировок. В процессе лечения у крыс-опухоленосителей отмечается наличие реакционноспособных этилениминных групп, в первую очередь в кровяном русле. Изучение циркуляции амитозина после внутрибрюшинного введения показало, что накопление этилениминных групп в сыворотке крови через 3 ч с момента введения составляет 2,0±0,025, через сутки оно достигает 70,2±16 мкг/мл. В течение вторых суток наблюдается достоверное снижение их содержания до 0,12±0,012 мкг/мл (табл. 32).
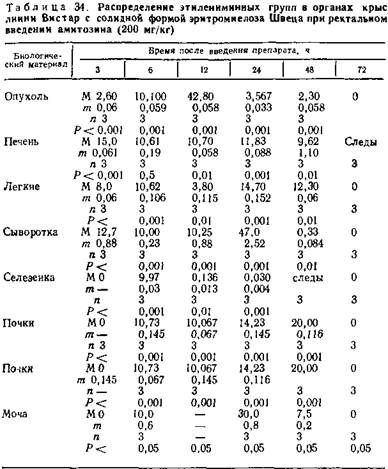
При введении препарата ректально в виде свечей содержание этилениминных групп к 24 ч с момента введения в сыворотке крови достигает лишь 47,0±2,52 мкг/мл. По истечении вторых суток они определяются лишь в незначительных количествах (0,33±0,3 мк/мл).
Отмечена характерная динамика содержания этилениминных групп в опухолевой ткани и внутренних органах при внутрибрюшинном введении. В печени характерны довольно низкие концентрации в течение первых 12 ч (0,134±0,018 мкг/г — 0,76±0,01б мкг/г). Лишь на вторые сутки происходит увеличение концентрации до 16,3± ±0,05 мкг/г.
Но уже на третьи сутки препарат в этом участке полностью исчезает (табл. 33).
В селезенке активные этилениминные группировки выявляются в концентрациях 11,50±0,58 мкг/г и 10,08±0,64 мкг/г при внутрибрюшинном введении в течение 48 ч. Ректальное введение способствует их содержанию уже через 6 ч после введения (9,97±0,08 мкг/г) и резкому снижению доследовых количеств через 24 ч (0,08 ±0,004 мкг/г).
При внутрибрюшинном введении препарат в почках накапливается максимально в первые сутки от момента введения (30,0 мкг/г) и падает до нуля к 48 ч. При ректальном введении максимальное содержание этилениминных групп фиксируется в первые три часа после введения (24,0 мкг/г), а затем через 12 ч происходит их снижение (10,067±0,067 мкг/г).
На 48 ч от момента введения снова наблюдается повышение концентрации (20,00±0,16 мкг/г). Полное выведение препарата происходит лишь на третьи сутки. В моче он определяется сразу же в первые часы после введения (ем. табл. 33).
В легких при внутрибрюшинном (см. табл. 33) и при ректальном введении (табл. 34) отмечено волнообразное накопление этилениминных групп.
Особое значение в этих опытах имеет динамика препарата в опухолевой ткани. В ней накопление этилениминных групп происходит постепенно при внутрибрюшинном введении — в течение 12 ч (от 6,37±0,033 мкг/г до 12,16± ±0,08 мкг/г). При ректальном введении опухоль накапливает препарат максимально в течение первых 12 ч после введения (42,8±0,058 мкг/г). Во второй половине первых суток уже происходит снижение концентрации до минимального содержания (2,30±0,058 мкг/г) в течение вторых суток. На третьи сутки этилениминные группы в опухоли не определяются.
А.И.Потопальский
Препараты чистотела в биологии и медицине
|