5.7. ОСОБЕННОСТИ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ПРЕПАРАТА АМИТОЗИН
Амитозин, являясь производным суммы алкалоидов чистотела большого и тиофосфамида, обладает выраженной противоопухолевой активностью при слабо выраженных побочных явлениях. Наряду с этим препарат имеет ряд характерных особенностей фармакологического действия: возбуждающее ЦНС, антигистаминное, папавериноподобное, местноанестезирующее и курареподобное. Указанные свойства препарата обусловлены алкалоидной частью его молекулы. Из побочных явлений препарата установлено нарушение проводимости импульсов по проводящей системе на изолированном сердце лягушки. Последнее явление связано с изохинолиновой структурой алкалоидов чистотела. Таким образом, в механизме фармакологического действия амитозина преобладают проявления, обусловленные алкалоидной частью его молекулы. В связи с возникновением некротических изменений при внутри- и подкожном введении препарата рекомендуется только внутримышечное и внутриполостное его применение, а также: наружно — в форме мази, ректально — в свечах.
Результаты изучения особенностей влияния амитозина на опухоль и пораженный ею организм свидетельствуют об изменении интимных механизмов клеточного метаболизма опухоли под влиянием препарата. Эти изменения приводят к гибели большинства опухолевых клеток, однако не исключена возможность дифференциации части из них. С помощью биохимического и флюоресцентного анализа подтверждены имеющиеся экспериментальные данные о значительном тропизме препарата к опухолевой ткани.
В процессе лечения у животных отмечалось постепенное повышение показателей реактивности организма.
Наличие собственной флуоресценции способствует изучению фармакодинамики препарата с ее визуализацией, что особенно ценно при определении степени метастазирования в момент операции.
Учитывая наличие у препарата характерного для него спектра действия на экспериментальные опухоли, отличающегося от тиофосфамида, при клиническом изучении целесообразно определить эффективность амитозина как у больных с чувствительными к тиофосфамиду опухолями, так и с резистентными. Особый интерес представляют наблюдения при возникшей к тиофосфамиду резистентности опухолей, осложненной лекопенией. Кроме того, целесообразно также изучение больных с доброкачественными опухолями (полипы и папилломы, аденомы и т. д.).
Перспективным является исследование амитозина на различных моделях вирусной и бактериальной этиологии. Материалы экспериментального изучения биологической активности амитозина послужили основой для рекомендации проведения клинических испытаний его эффективности у больных злокачественными опухолями.
5.8. ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ ОТДЕЛЬНЫХ ПРОИЗВОДНЫХ АЛКАЛОИДОВ ЧИСТОТЕЛА
При изучении противоопухолевой активности тиофосфамидных производных отдельных алкалоидов чистотела (хелидонин, сангвинарин, берберин) оказалось, что наиболее перспективным из них является продукт алкилирования берберина, имеющий четко выраженный широкий спектр терапевтического действия.
В результате первичного отбора препаратов хелидонина и продуктов его алкилирования тиофосфамидом на экспериментальных опухолях мышей установлено отсутствие специфической активности хелидонина при 10 ежедневных инъекциях в максимально переносимых дозах на саркому Крокера, карциному Эрлиха (солидные варианты) и лимфосаркому ЛИО-1.
Ди-три-производные хелидонина с тиофосфамидом оказали незначительное противоопухолевое действие на карциному мышей Эрлиха. Процент торможения роста равен 16,7 и 24,15 при отсутствии статистической достоверности.
Несколько выше противоопухолевая активность препаратов сангвинарина. Алкалоид сангвинарин в максимально переносимой разовой дозе 10 мг/кг при пяти введениях совершенно не угнетал рост карциномы Герена и лишь на 10,4 и 24,3 % вызвал угнетение роста карциномы крыс ОЯ и гепатомы РС-1. В то же время ди-производный продукт его алкилирования тиофосфамидом в адекватных дозах вызвал значительное угнетение роста этих опухолей крыс при отсутствии угнетающего действия на кроветворение. Процент торможения роста гепатомы РС-1 достигает 96,2, а карциномы яичников ОЯ — 54. При этом отмечены характерные для алкалоидэтилениминов изменения структуры опухолей.
Алкилированный тиофосфамидом берберин (берберин-тиофосфамид-трибетамид) оказался активным и перспективным противоопухолевым препаратом с широким спектром действия.
5.8.1. Токсичность трибетамида. Для этого препарата были установлены видовые отличия в токсичности. Так, ЛД50 его при однократном внутрибрюшинном введении крысам составляет 300 мг/кг, а хомякам 130 мг/кг. Наиболее токсичен берберин-тиофосфамид для лягушек — ЛД50 равна 26,5 мг/кг, что совпадает с наиболее выраженной токсичностью для этих животных и продукта взаимодействия суммы алкалоидов чистотела с тиофосфамидом (табл. 41).
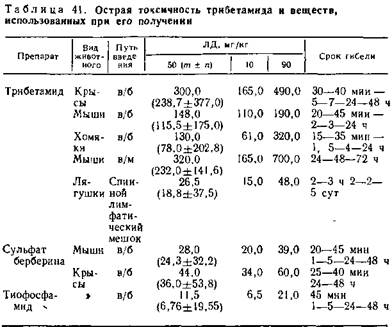
Проявления острого токсического действия препарата у различных видов животных однотипны и выражались симптомами, характерными для острого отравления природными и модифицированными соединениями берберина.
В результате изучения острой токсичности трибетамида на собаках установлена зависимость продолжительности жизни животных от доз. Однократное внутрибрюшинное введение 1000 мг/кг привело к резкому угнетению животного, падению кровяного давления, брадикардии, нарушению ритма и снижению частоты дыхания. Через 3,5 ч наступила смерть от остановки дыхания. При введении 500 мг/кг гибель наступала через 3—5 ч после инъекции, 250 мг/кг — через 48 ч. Однократное введение препарата в дозе 125 мг/кг не вызывало существенных изменений состояния животного в течение всего двухмесячного срока наблюдений. Значительных колебаний в составе периферической крови собак спустя 24 ч после введения смертельных доз препарата не наблюдалось, однако отмечена тенденция к увеличению количества лейкоцитов.
Патоморфологическим исследованием внутренних органов животных, погибших от летальных доз, обнаружены дистрофические изменения в печени, почках, сердце и легких. В печени нарушается четкость структуры, наблюдаются дегенеративные изменения протоплазмы и ядер клеток. В почках наблюдаются явления белковой дистрофии эпителия канальцев.
Влияние длительного введения трибетамида изучено на крысах и морских свинках. После десятикратного ежедневного введения его крысам в дозе 30 мг/кг отклонений показателей периферической крови, веса животных и внутренних органов не выявлено. ЛД50 при хроническом введении составляет для крыс 90 мг/кг. Морским свинкам трибетамид вводился на протяжении 10 дней внутрибрюшинно в дозах 50 и 80 мг/кг.
Фармакологические эффекты трибетамида напоминают уже описанные при изучении амитозина.
Полный анализ периферической крови делали в начале опыта, после 5 и 10 инъекций препарата, а также спустя 10 дней после окончания курса. Подсчет миелограмм и гистологическое исследование костного мозга и селезенки проводились в конце курса лечения и через 10 дней после прекращения введений препарата.
Результаты исследования периферической крови свидетельствуют о том, что значительных изменений показателей под влиянием трибетамида не происходит. Так, наблюдается увеличение количества тромбоцитов через 10 дней после курса введений препарата (в разовой дозе 50 мг/кг) до 162,140±3,640 при исходном значении этого показателя 123,3± 12,8. После 5 инъекций препарата в разовой дозе 50 мг/кг наблюдался лейкоцитоз, а также увеличение процентного содержания палочкоядерных лейкоцитов. Подобный сдвиг лейкоцитарной формулы влево отмечался также при введении препарата в дозе 80 кг/кг во все сроки наблюдения. Лейкопенического эффекта, характерного для воздействия существующих противоопухолевых препаратов, в наших опытах не обнаружено.
Подсчет миелограмм подопытных животных показал, что введение препарата сопровождается увеличением числа нейтрофильных миелоцитов. Определенной закономерности в колебаниях других показателей не наблюдалось. Однако через 10 дней после окончания курса введений препарата в обеих дозах показатели миелограммы нормализовались.
Парциальный анализ миелограмм выявил, что достоверных изменений функционального состояния костного мозга при воздействия грибетамида в различных дозах не наблюдается.
Микроскопический анализ не обнаружил признаков деструкции костного мозга при курсовом воздействии исследуемого препарата. Гистологическое исследование декальцинированных препаратов костного мозга из трубчатых костей бедра подопытных животных показало отсутствие морфологических признаков гипо- и апластического состояний костного мозга, характерного для действия алкилирующих агентов.
При микроскопическом исследовании селезенки животных, получавших трибетамид, выявлена нормальная структура этого органа с четко сформированными фолликулами, без признаков деструкции элементов красной и белой пульпы. Отмечается только более выраженный гемосидоз селезенки у животных, подвергшихся воздействию исследуемого препарата.
В результате проведения комплексного исследования процесса воздействия трибетамида на кроветворные органы интактных животных установлено отсутствие непосредственного цитопатогенного действия исследуемого препарата на клеточные элементы кроветворной системы, присущего большинству современных противоопухолевых средств.
Для углубленного изучения процесса воздействия на костный мозг трибетамида был использован люминесцентно-микроскопический метод с применением тушителя флуоресценции неповрежденных клеток. Обнаружена характерная микроскопическая картина клеток костного мозга интактных животных в суправительно флуорохромированных мазках (без применения тушителя). Ядра большинства клеток флуоресцируют в зеленых тонах, а цитоплазма — в зеленых, красных и оранжевых. В миелобластах на фоне зеленого ядра выявляются оранжевые ядрышки и оранжевая цитоплазма. Цитоплазма промиелоцитов содержит грубую оранжевую зернистость. У нейтрофильных миелоцитов в цитоплазме на тускло-зеленом фоне оранжевая зернистость, ядра клеток зеленые. Эозинофильные миелоциты содержат зеленое ядро и тусклозеленую цитоплазму с крупной оранжевой зернистостью. Проэритробласты имеют ярко-зеленое ядро, оранжевые ядрышки и красную цитоплазму. По мере созревания клетки эритроидного ростка теряют ядрышки, ядро приобретает все более тусклое свечение, переходящее в оранжевые тона. Мегакариоциты содержат желто-зеленое ядро и тускло-зеленую цитоплазму. Добавление к флуорохрому конго красного приводит к исчезновению описанной картины и под люминесцентным микроскопом видны лишь очень тускло светящиеся зеленым светом ядра клеток.

В наших опытах в качестве одного из контролен использована люминесцентно-микроскопическая картина костного мозга животных, наблюдаемая через 6 ч после однократного внутрибрюшинного введения сарколизина в дозе 30 мг/кг и тиофосфамида в дозе 10 мг/кг. При этом четко выявлялись характерные после воздействия алкилирующих веществ микронекротические очаги и отдельные дегенеративно измененные клетки в костном мозге животных, получавших алкилирующие препараты.
После введения трибетамида внутрибрюшинно в дозе 120 мг/кг, что составляет 1/2 ЛД50, проведено сравнительное флуорохромирование мазков костного мозга с последующим исследованием через 3, 6, 12, 24 и 48 ч спустя. После однократного введения препарата микронекротические очаги в костном мозге животных не выявлялись. В этой связи исследовали мазки костного мозга животных после курсового применения трибетамида в дозе 80 мг/кг. Флуорохромированные микроскопические препараты изготовлялись в разные сроки (3, 6 и 12 ч) после последнего введения препаратов. Однако и при такой схеме опыта микронекротические очаги в костном мозге не были обнаружены.
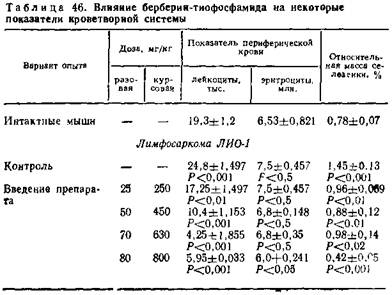
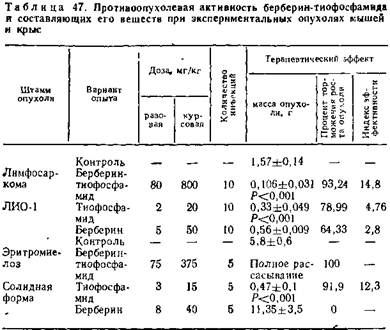
5.8.2. Антибластический эффект трибетамида. Противоопухолевая активность берберин-тиофосфамида более выражена, чем у составляющих его компонентов. Препарат полностью излечивает асцитную форму гемоцитобластоза Швеца у крыс, на 95,4 и 97,1 % тормозит рост таких опухолей крыс, как карцинома Генера и карциносаркома Уокера, а также на 83 % гепатому РС-1.
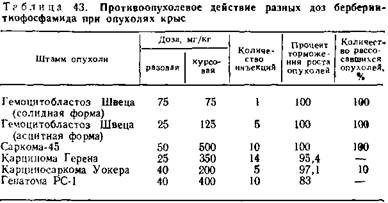
Эффективен он и при опухолях мышей. Процент торможения при лимфосаркоме ЛИО-1 достигает 93,24, саркоме 180—91,42, меланоме Гардинг—Пасси — 69,64, солидном и асцитном варианте саркомы 37 — 44,2 и 44,7. Не действует только на карциному мышей Эрлиха (табл. 42—44).
При этом заметного угнетения кроветворения у подопытных животных не наблюдается. Выраженность эффекта зависит от доз препарата (табл. 45, 46).
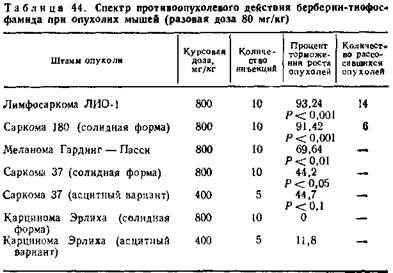
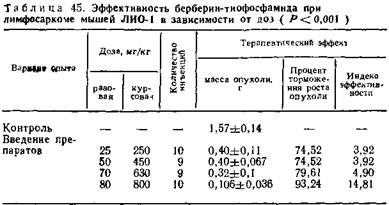
При изучении сравнительной эффективности трибетамида и веществ, использованных при его получении, установлены явные преимущества этого нового фитохимического препарата. Влияние длительного введения трибетамида на организм изучалось также на крысах-опухоленосителях с перевиваемым слизистым раком РС-1.
Введение препаратов (трибетамид в дозах 50 и 80 мг/кг, тиофосфамид в дозе 3 мг/кг) начинали на 21-й день после инокуляции опухолей. Химиотерапевтический курс состоял из 10 ежедневных внутрибрюшинных инъекций.
Исследование периферической крови проводилось накануне курса введений, после 5 и 10 инъекций, а также через 10 дней после прекращения введений препаратов. Гистологическое исследование костного мозга грудины и количественный подсчет миелокариоцитов в 1 мм3 осуществлялись после курса введений препаратов и через 10 дней после окончания введений. Оценка противоопухолевого действия производилась в то же время.
Данные о противоопухолевой активности и влиянии препаратов на содержание миелокариоцитов в 1 мм3 костного мозга приведены в таблицах 47, 48.
Определенная зависимость между противоопухолевым действием и содержанием миелокариоцитов в костном мозге не отмечена. После окончания курса введений трибетамида наблюдается незначительная миелокариоцитопения, однако после курса тиофосфамида снижение количества миелокарцитов выражено в более значительной степени и их содержание достигает лишь 33 % исходного.
В последующие 10 дней после прекращения курса введений препаратов наблюдается выраженное последействие на опухолевый процесс, что выражается в увеличении процента торможения роста опухолей. Кроме того, отмечается увеличение содержания миелокариоцитов в костном мозге, особенно в тех группах, где оно было значительно снижено к моменту окончания курса введений.
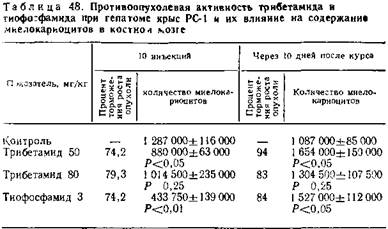
Динамика количественных показателей периферической крови в процессе лечения трибетамидом свидетельствует о значительном влиянии препарата в дозе 50 мг/кг на количественный состав форменных элементов крови. Наблюдаемые изменения находятся в пределах физиологической нормы. При применении препарата в дозе 80 мг/кг уже после пяти инъекций отмечается незначительная анемия, сопровождающаяся реакцией раздражения эритроцидного ростка костного мозга, что выражается в увеличении количества ретикулоцитов. Кроме того, препарат к концу курса введений вызывает некоторую лейкопению, достигающую 13120± 2970 за счет уменьшения абсолютного количества лимфоцитов. Тем не менее по истечении десятидневного срока после окончания курса введений указанные показатели нормализуются.
При гистологическом исследовании декальцинированных препаратов грудины контрольных животных костный мозг содержит небольшое количество жира (около 20 %).
Хорошо развит мегакариоцитный аппарат. На большом увеличении клеточные элементы дифференцируются с трудом. При введении трибетамида отмечаются незначительное увеличение содержания жира и некоторое уменьшение количества ядросодержащих клеток в костном мозге. После курсового введения тиофосфамида наблюдается значительно выраженная гипоплазия костного мозга Ретикулярная строма заполнена большим количеством эритроцитов.
Через 10 дней после прекращения введений трибетамида наблюдается нормальная структура костного мозга с тенденцией к гиперплазии миелоидного роста, что подтверждается также увеличением количества миелокариоцитов при прямом подсчете. После 10-дневного курса тиофосфамида отмечаются значительное жировое перерождение и гипоплазия костного мозга, т. е. к наблюдаемому сроку не восстанавливается полная морфология этого органа.
Таким образом, алкалоидэтиленимины не угнетают кроветворение у интактных животных и в то же время вызывают преходящую лейкопению и миелокарцитопению у опухоленосителей. Последнее явление может быть связано с активацией препарата в опухоли и утечкой их активной формы в кровяное русло, что приводит к обычным для алкилирующих агентов побочным эффектам.
Приведенные данные свидетельствуют о том, что препарат трибетамид выгодно отличается от алкилирующих агентов и антимитотических веществ по своему действию на пролиферирующие нормальные ткани, не вызывая, в частности, микронекротических очагов, т. е. не воздействуя непосредственно на нуклеопротеиды костномозговых клеток. Это позволяет сделать предположение о существовании их в кровяном русле в неактивной форме, не допускающей к протеканию реакций непосредственного алкилирования субстратов быстро регенерирующих нормальных тканей. В то же время трибетамид обладает выраженной противоопухолевой активностью, что наводит на мысль о его, по всей вероятности, энзимной активности опухолевой тканью с высвобождением реакционноспособных групп, вступающих в реакции переалкилирования, так как морфологические и гистохимические проявления воздействия этих препаратов на опухоль напоминают эффект алкилирующих веществ.
Учитывая возможность образования комплексов берберина с носителем наследственной информации клетки ДНК, не исключен и механизм прямого действия продукта его алкилирования на ДНК со всеми вытекающими отсюда для раковых клеток последствиями.
Наличие яркой собственной флюоресценции берберина и его производных открывает путь для углубленного изучения этого явления.
В связи с незначительной токсичностью, широтой и выраженностью противоопухолевого действия с характерным спектром антибластической активности, а также отсутствием устойчивости опухолей и рецидивов после химиотерапии берберин-тиофосфамид (трибетамид) заслуживает тщательного клинического изучения у больных злокачественными опухолями и лейкозами. В первую очередь такое изучение целесообразно провести у больных с опухолями печени, желчевыводящих путей, желудочно-кишечного тракта и мышечной ткани, учитывая известный тропизм алкалоида берберина к этим органам.
Приведенные в этом разделе данные свидетельствуют о перспективности широкого клинического изучения полученных и изученных нами модифицированных алкалоидов чистотела. Необходимы также дальнейшие глубокие исследования продуктов модификации остальных алкалоидов чистотела, однако эти работы затруднены отсутствием необходимых количеств чистых алкалоидов. Такая задача может быть решена при объединении усилий исследователей, работающих с алкалоидами чистотела в разных учреждениях нашей страны и за рубежом (Польша, Чехо-Словакия, ФРГ, Болгария, Япония и др.).
5.9. ВОЗМОЖНЫЕ КАНЦЕРОГЕННЫЕ И ЭМБРИОТОКСИЧЕСКИЕ ЭФФЕКТЫ ПРЕПАРАТОВ ЧИСТОТЕЛА
Проводилось изучение мутагенной активности суммы алкалоидов чистотела и ее тиофосфамидного производного амитозина, а также алкалоида берберина и продукта его модификации — трибетамида на клетках костного мозга мышей, В сравнительных опытах использован тиофосфамид. В качестве контроля вводился растворитель. Установлено выраженное мутагенное действие терапевтических и токсических доз тоифосфамида при полном отсутствии такового в условиях введения растворителя. Препараты суммы алкалоидов — чистотела и их тиофосфамидные производные в терапевтических дозах мутагенной активностью не обладают. При токсических и субтоксических дозах этих веществ отмечено некоторое увеличение хромосомных аберраций.
Следует отметить резкое снижение мутагенной активности у тиофосфамидных производных даже таких известных мутагенов растительного происхождения, как колхицин и кохамин.
Все изучаемые препараты не обладали канцерогенным и тератогенным действием в опытах на мышах и крысах в условиях длительного введения.
Таким образом, препараты алкалоидов чистотела и их тиофосфамидные производные не проявляют выраженного мутагенного, онкогенного и тератогенного действия, что облегчает организацию их клинического изучения.
А.И.Потопальский
Препараты чистотела в биологии и медицине
|